Talazoparib
タラゾパリブ (ターゼナ®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ターゼナ® (添付文書)
PARP阻害薬 一般名:タラゾパリブ (ファイザー株式会社)
用法用量 (連日使用)
がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌
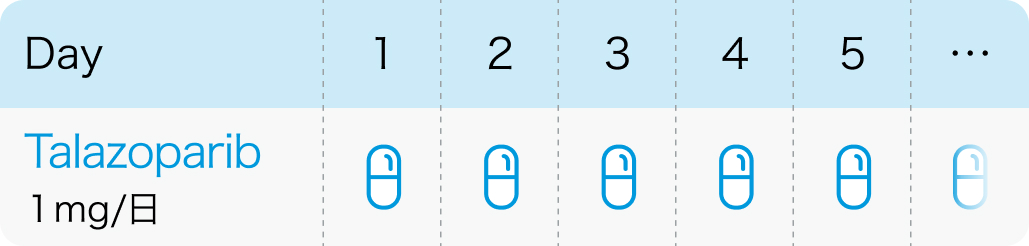
タラゾパリブとして1日1回1mgを経口投与
ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
※乳癌の適応は0.25mg、1mgカプセルのみ
0.1mgカプセルはBRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌のみ適応
ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
※電子添文記載のその他の注意点
中等度腎機能障害のある患者 (eGFR 30~<60 mL/min/1.73m²) は、0.75mgを開始用量とする
ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
減量レベル
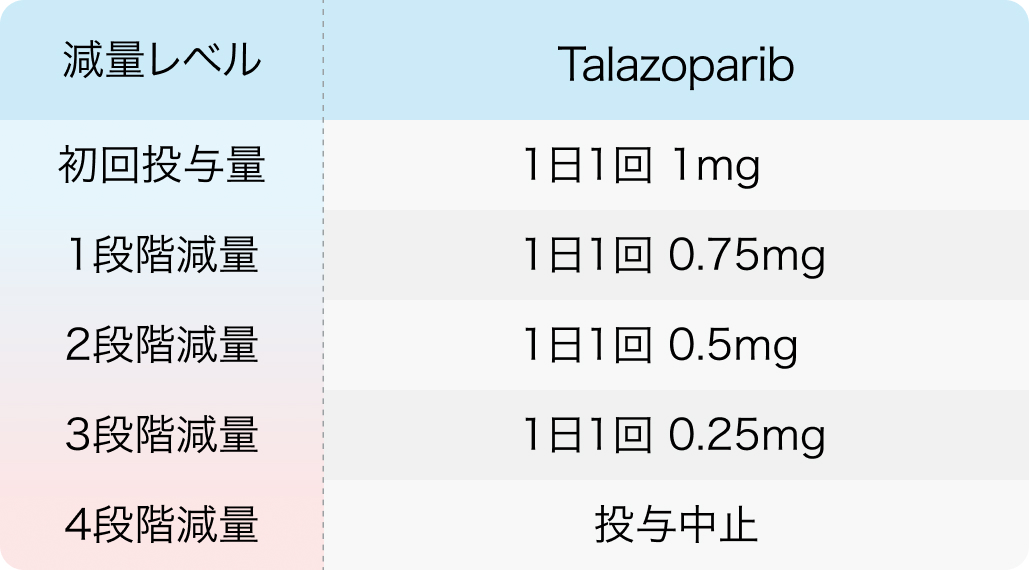
ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
投与開始基準
EMBRACA試験²⁾のプロトコールより引用
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者
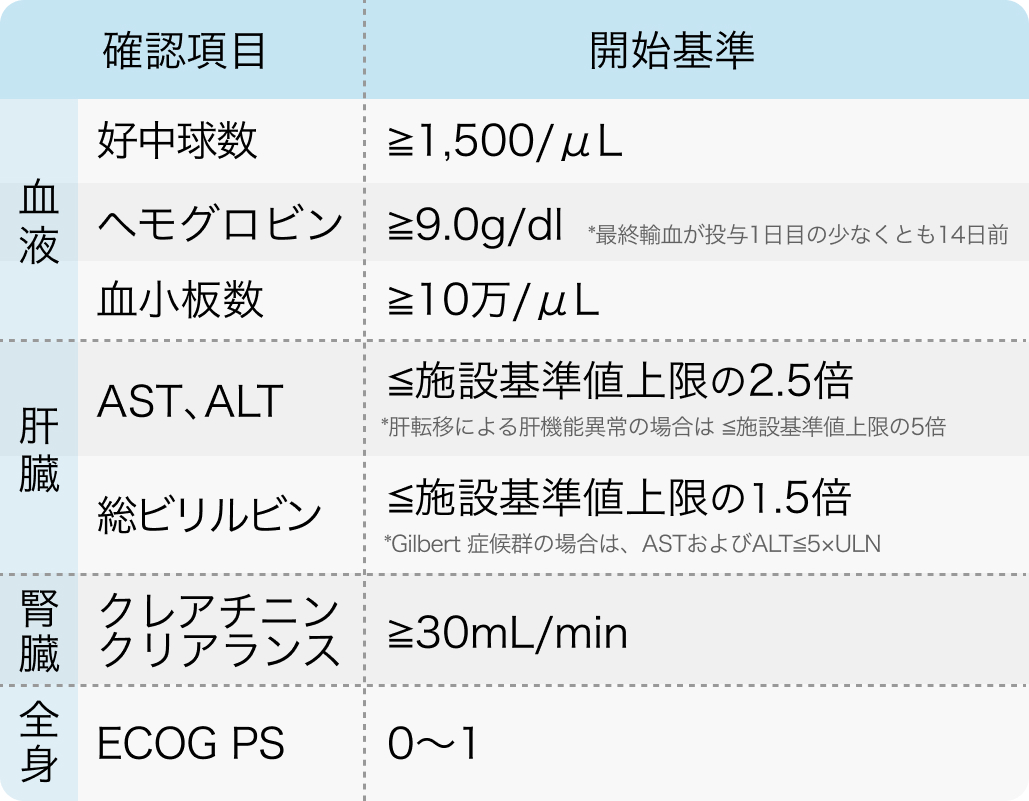
N Engl J Med. 2018 Aug 23;379(8):753-763.より作表
減量・休薬・中止基準
以下は電子添文より引用
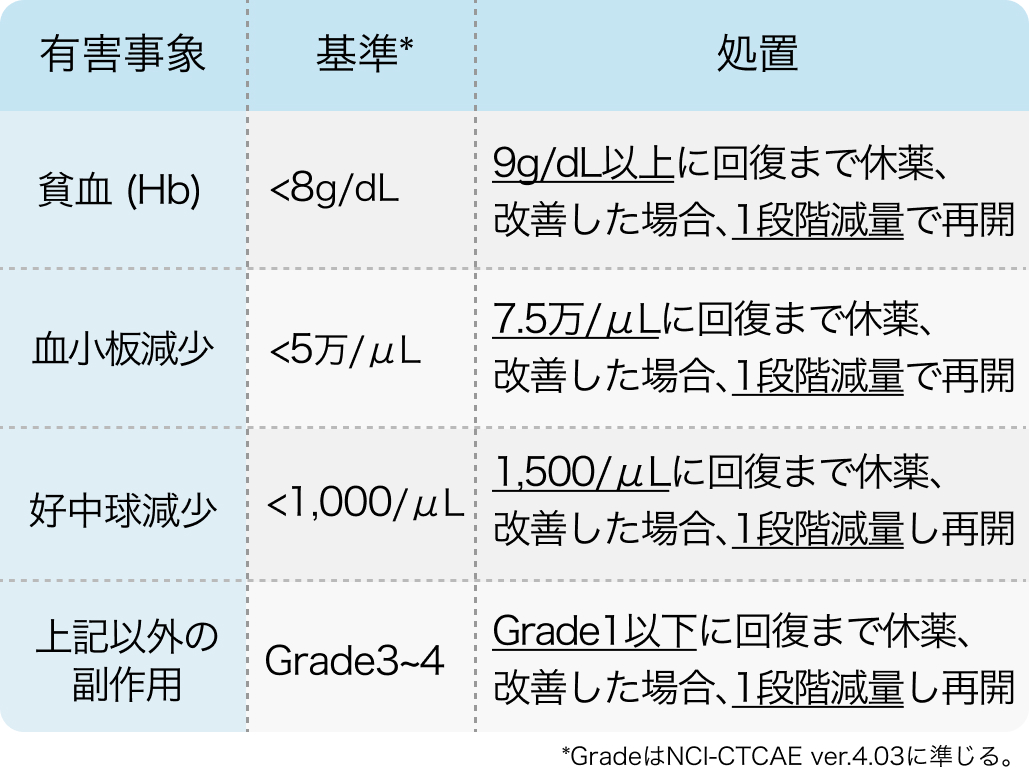
ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
主な有害事象
EMBRACA試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 39.2%*
- 好中球数減少 21.0%*
- 血小板数減少 14.7%*
- 白血球数減少 6.6%*
- リンパ球数減少 3.1%*
- 発熱性好中球減少症 0.3%*
*Grade3、 4のみのデータ
- 倦怠感 50.3% (1.7%)
- 悪心 48.6% (0.3%)
- 嘔吐 24.8% (2.4%)
- 下痢 22.0% (0.7%)
- 便秘 22.0% (0.3%)
- 食欲減退 21.3% (0.3%)
注意すべき有害事象
- 脱毛症 25.2% (0%)
- 手掌・足底発赤知覚不全症候群 1.4% (0.3%)
関連する臨床試験: EMBRACA試験
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者431例を対象に、 タラゾパリブ1mgを1日1回連続経口投与と標準治療群*の有効性を検討することを目的とした、 無作為化非盲検並行群間 海外第Ⅲ相試験²⁾
*カペシタビン、 エリブリン、 ゲムシタビン又はビノレル
以下はN Engl J Med. 2018 Aug 23;379(8):753-763.より引用
- mPFS:8.6ヵ月
標準治療群 5.6ヵ月、 HR 0.542, p<0.0001
- ORR:62.6%
標準治療群 27.2%、OR 4.99、 p<0.001
- mOS 22.3ヵ月
標準治療群 19.5ヵ月、 HR 0.76、 p=0.105
盲検下独立中央評価による無増悪生存期間のKaplan-Meier曲線 (全解析対象集団)
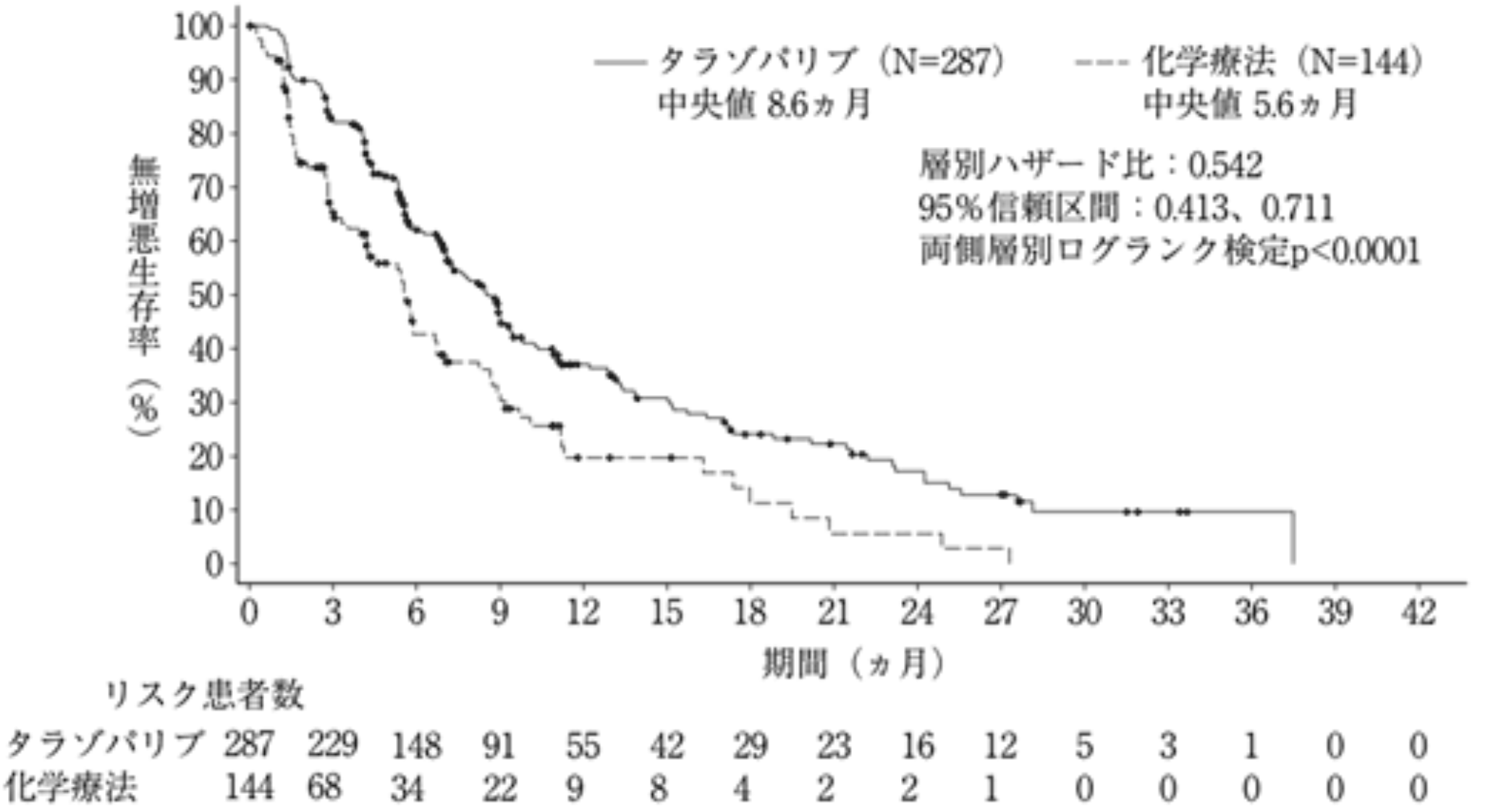
ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
参考文献
1) ファイザー株式会社. ターゼナ® 電子添文 2024年1月作成 (第1版)
最終更新日 : 2024年2月23日
監修医師 : HOKUTO編集部監修医師
Talazoparib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ターゼナ® (添付文書)
PARP阻害薬 一般名:タラゾパリブ (ファイザー株式会社)
用法用量 (連日使用)
がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌

タラゾパリブとして1日1回1mgを経口投与
ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
※乳癌の適応は0.25mg、1mgカプセルのみ
0.1mgカプセルはBRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌のみ適応
ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
※電子添文記載のその他の注意点
中等度腎機能障害のある患者 (eGFR 30~<60 mL/min/1.73m²) は、0.75mgを開始用量とする
ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
減量レベル

ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
投与開始基準
EMBRACA試験²⁾のプロトコールより引用
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者

N Engl J Med. 2018 Aug 23;379(8):753-763.より作表
減量・休薬・中止基準
以下は電子添文より引用

ターゼナ® 電子添文 2024年1月作成 (第1版)より作表
主な有害事象
EMBRACA試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 39.2%*
- 好中球数減少 21.0%*
- 血小板数減少 14.7%*
- 白血球数減少 6.6%*
- リンパ球数減少 3.1%*
- 発熱性好中球減少症 0.3%*
*Grade3、 4のみのデータ
- 倦怠感 50.3% (1.7%)
- 悪心 48.6% (0.3%)
- 嘔吐 24.8% (2.4%)
- 下痢 22.0% (0.7%)
- 便秘 22.0% (0.3%)
- 食欲減退 21.3% (0.3%)
注意すべき有害事象
- 脱毛症 25.2% (0%)
- 手掌・足底発赤知覚不全症候群 1.4% (0.3%)
関連する臨床試験: EMBRACA試験
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者431例を対象に、 タラゾパリブ1mgを1日1回連続経口投与と標準治療群*の有効性を検討することを目的とした、 無作為化非盲検並行群間 海外第Ⅲ相試験²⁾
*カペシタビン、 エリブリン、 ゲムシタビン又はビノレル
以下はN Engl J Med. 2018 Aug 23;379(8):753-763.より引用
- mPFS:8.6ヵ月
標準治療群 5.6ヵ月、 HR 0.542, p<0.0001
- ORR:62.6%
標準治療群 27.2%、OR 4.99、 p<0.001
- mOS 22.3ヵ月
標準治療群 19.5ヵ月、 HR 0.76、 p=0.105
盲検下独立中央評価による無増悪生存期間のKaplan-Meier曲線 (全解析対象集団)

ターゼナ® 電子添文 2024年1月作成 (第1版)より引用
参考文献
1) ファイザー株式会社. ターゼナ® 電子添文 2024年1月作成 (第1版)
最終更新日 : 2024年2月23日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。