Nogitecan
ノギテカン (ハイカムチン®)
Nogitecan:ノギテカン(ハイカムチン®)
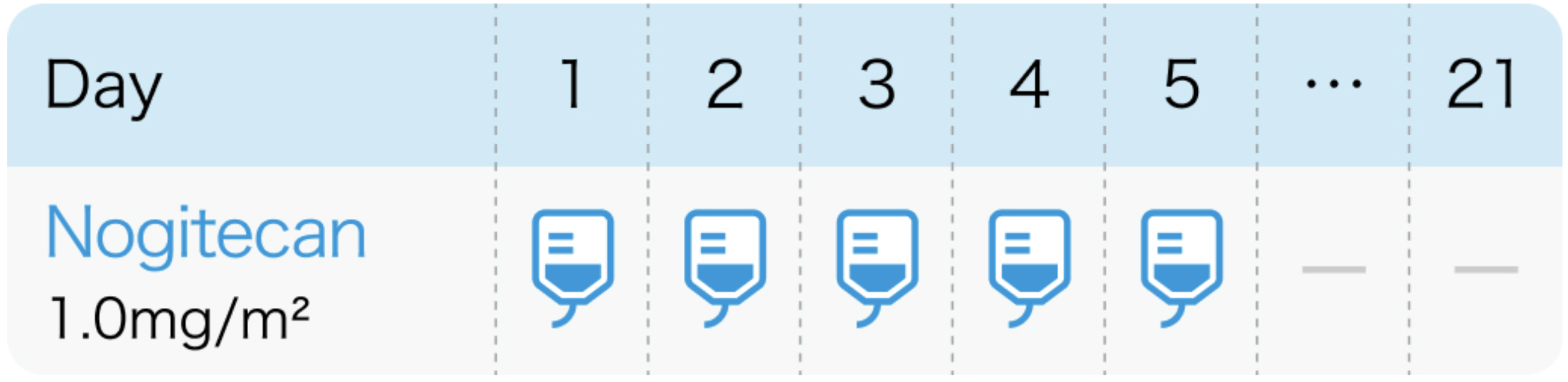
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.0mg/m² | 1~ | Day1~5 |
前投薬
| デキサメタゾン3.3~6.6mg 静注 (4~8mg経口) 単剤投与 |
| 状況に応じてプロクロルペラジンもしくはメトクロプラミドの使用やロラゼパムやH2受容体拮抗薬あるいはプロトンポンプ阻害薬の併用も検討 |
その他
| 1コース21日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本化薬株式会社の外部サイトへ遷移します
用法用量
前投薬
デキサメタゾン3.3~6.6mg 静注 (4~8mg経口) 単剤投与
状況に応じてプロクロルペラジンもしくはメトクロプラミドの使用やロラゼパムやH2受容体拮抗薬あるいはプロトンポンプ阻害薬の併用も検討
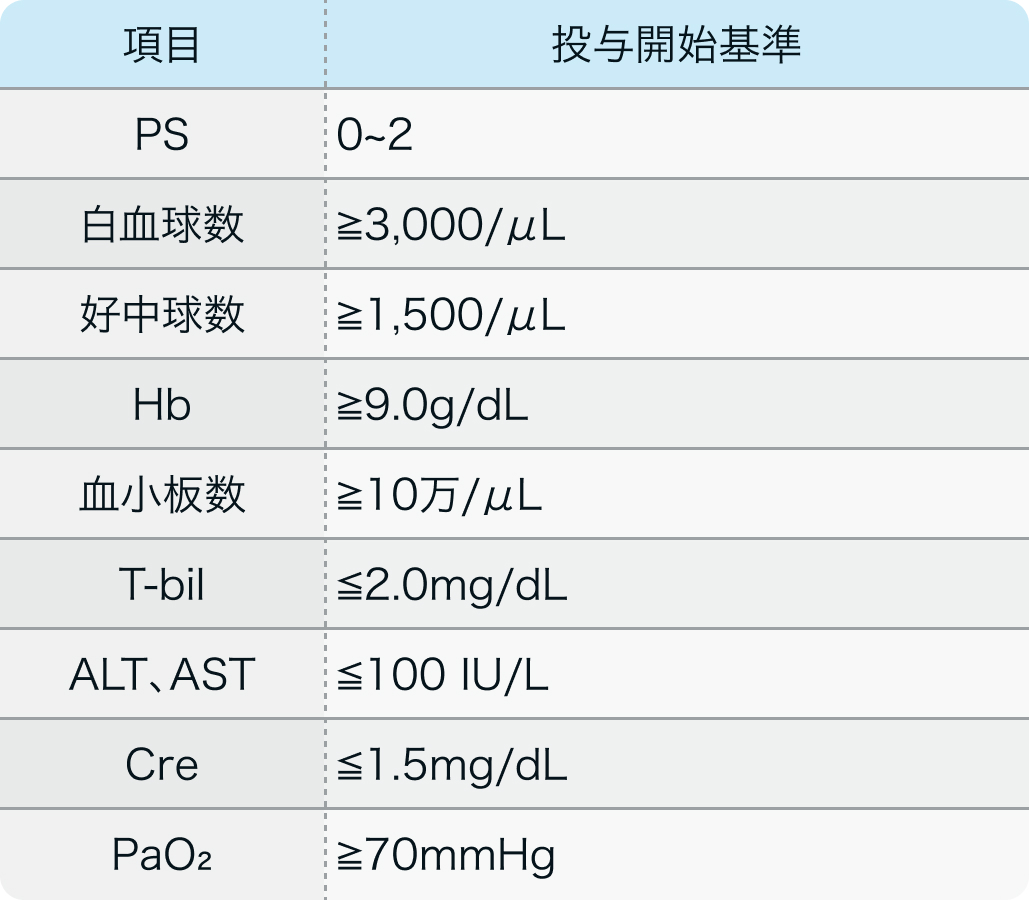
投与開始基準
JCOG0605試験¹⁾より抜粋
20~75歳で、 組織学的または細胞学的に小細胞肺癌が確認され、 プラチナ製剤をベースとした一次化学療法または放射線療法が奏効した以下に該当する患者
増量・減量基準
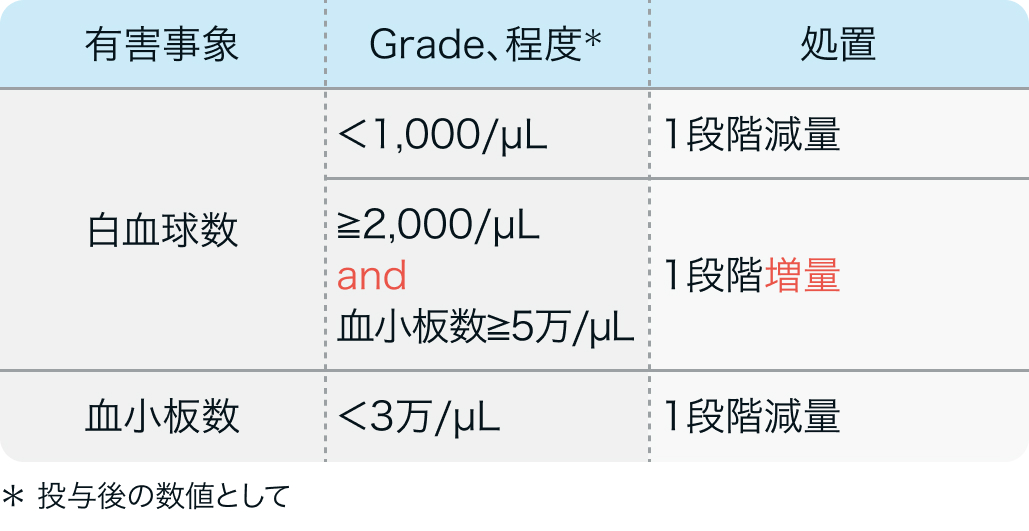
初回基準量と増減量レベル

主な有害事象
JCOG0605試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球数減少 100% (85.6%)
- 白血球数減少 98.9% (51.1%)
- 貧血 88.9% (27.8%)
- 血小板数減少 77.8% (27.8%)
- ALT上昇 36.7% (1.1%)
- AST上昇 25.6% (0%)
- 悪心 45.6% (2.2%)
- 便秘 41.1% (1.1%)
- 倦怠感 37.8% (1.1%)
- 発熱 15.6% (1.1%)
- 下痢 13.3% (0%)
- 嘔吐 8.9% (0%)
- 粘膜炎 (臨床検査) 7.8% (0%)
- 粘膜炎 (機能性または症候性) 6.7% (0%)
注意すべき有害事象
- 脱毛症 27.8% (0%)
特徴と注意点
欧米における2次治療の標準レジメン*だが、 国内ではAMR (Amrubicin) が主流である。
*投与量が国内外で異なる
出典
最終更新日 : 2023年12月25日
監修医師:HOKUTO編集部医師監修
Nogitecan
Nogitecan:ノギテカン(ハイカムチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.0mg/m² | 1~ | Day1~5 |
前投薬
| デキサメタゾン3.3~6.6mg 静注 (4~8mg経口) 単剤投与 |
| 状況に応じてプロクロルペラジンもしくはメトクロプラミドの使用やロラゼパムやH2受容体拮抗薬あるいはプロトンポンプ阻害薬の併用も検討 |
その他
| 1コース21日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本化薬株式会社の外部サイトへ遷移します
用法用量

前投薬
デキサメタゾン3.3~6.6mg 静注 (4~8mg経口) 単剤投与
状況に応じてプロクロルペラジンもしくはメトクロプラミドの使用やロラゼパムやH2受容体拮抗薬あるいはプロトンポンプ阻害薬の併用も検討
投与開始基準
JCOG0605試験¹⁾より抜粋
20~75歳で、 組織学的または細胞学的に小細胞肺癌が確認され、 プラチナ製剤をベースとした一次化学療法または放射線療法が奏効した以下に該当する患者

増量・減量基準

初回基準量と増減量レベル

主な有害事象
JCOG0605試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球数減少 100% (85.6%)
- 白血球数減少 98.9% (51.1%)
- 貧血 88.9% (27.8%)
- 血小板数減少 77.8% (27.8%)
- ALT上昇 36.7% (1.1%)
- AST上昇 25.6% (0%)
- 悪心 45.6% (2.2%)
- 便秘 41.1% (1.1%)
- 倦怠感 37.8% (1.1%)
- 発熱 15.6% (1.1%)
- 下痢 13.3% (0%)
- 嘔吐 8.9% (0%)
- 粘膜炎 (臨床検査) 7.8% (0%)
- 粘膜炎 (機能性または症候性) 6.7% (0%)
注意すべき有害事象
- 脱毛症 27.8% (0%)
特徴と注意点
欧米における2次治療の標準レジメン*だが、 国内ではAMR (Amrubicin) が主流である。
*投与量が国内外で異なる
出典
最終更新日 : 2023年12月25日
監修医師:HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
