Sotorasib
ソトラシブ (ルマケラス®︎)
Sotorasib:ソトラシブ(ルマケラス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 960mg/日 | 連日内服 | Day1~ |
その他
| 適正使用ガイドに準じて、 下痢や肝機能障害では休薬・減量を行う。 |
| 適応は、がん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCである。 |
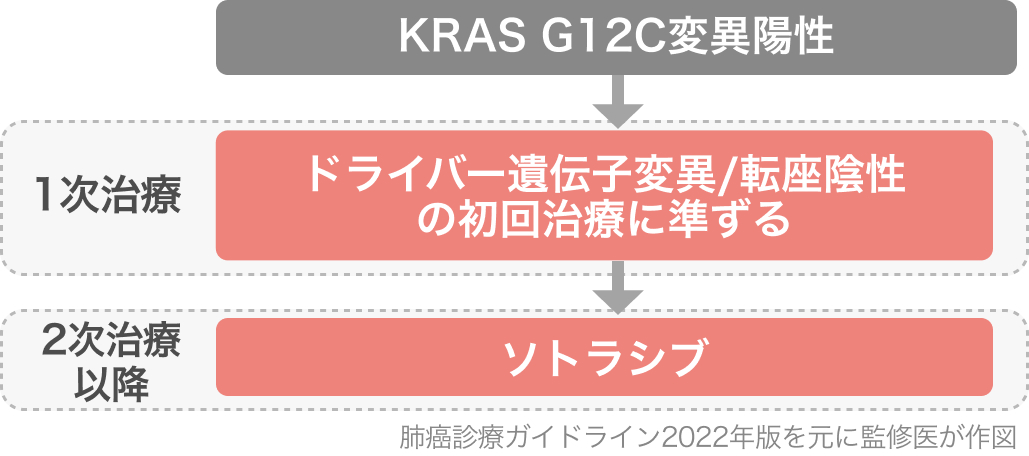
| 2次治療以降でソトラシブ単剤療法を行うよう推奨されている (肺癌診療ガイドライン 2022年版)。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アムジェン株式会社の外部サイトへ移動します
用法・用量
通常、 成人にはソトラシブとして960mgを1日1回経口投与。 なお、 患者状態により適宜減量。
減量レベル¹⁾
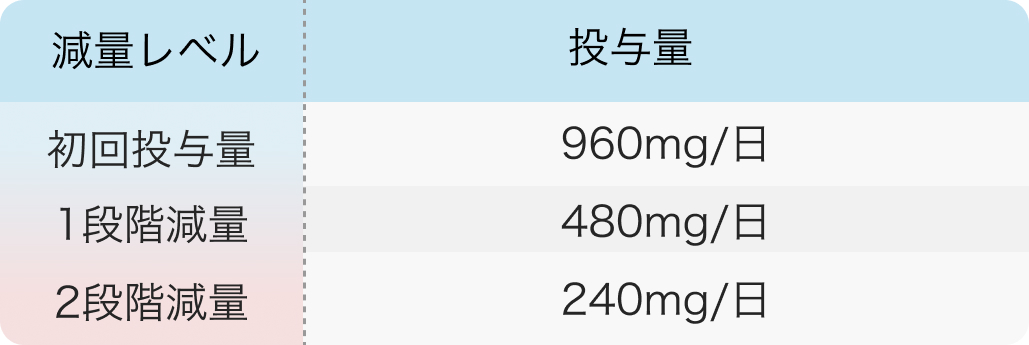
休薬・減量基準¹⁾

CTCAE ver5:AST増加 / ALT増加 / 肺臓炎
レジメンの特徴と注意点
KRAS G12C変異陽性 / 2次治療以降
適応はがん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCであり、 「肺癌診療ガイドライン 2022年版」では2次治療以降でソトラシブ単剤療法を行うよう推奨されている (推奨・エビデンス 1C、 合意率67%)
KRAS活性化変異はNSCLCの25~39%に、 KRAS G12C変異は肺腺癌の13~16%に発生する²⁾
遺伝子変異とコンパニオン診断
KRASは、 RASがん遺伝子 (KRAS、HRAS、NRAS) のうちの1つである。 RASがん遺伝子は、約19%と全がん腫で最も高頻度にみられるがん遺伝子である。 欧米の肺腺がんの約30%、 日本の肺腺がんの約10%で見つかるとされる³⁾。
コンパニオン診断の最新情報について、 こちらのコンテンツを参照ください。
肺癌コンパニオン診断薬一覧ページへ遷移
使用におけるワンポイント
有害事象は主に消化器毒性と肝障害なので、 比較的使用しやすいレジメンである。 ただし、 2nd line以降で使用することになるので、 前治療で免疫チェックポイント阻害薬(ICI)が入っている場合は1か月以上空けた方がよい。
関連する臨床試験
CodeBreak 200試験²⁾
Lancet. 2023;S0140-6736(23) 00221-0.
22か国148施設のランダム化非盲検第3相試験
KRAS G12C変異を有す18歳以上のNSCLCで、 プラチナ製剤併用療法およびPD-1、 PD-L1阻害剤の前治療後に進行した患者を345名が無作為に1:1で割り付けられた (171例と174例)。
・ソトラシブ経口投与 (960mg1日1回)
・ドセタキセル静注 (75mg/m²を3週に1回)
除外:他のドライバー遺伝子変異陽性、ドセタキセル治療歴など
有効性結果
追跡期間中央値17.7ヵ月で、 無増悪生存期間 (PFS) 中央値はソトラシブ群で5.6カ月、 ドセタキセル群で4.5カ月であった (HR 0.66;p=0.002)、 12ヶ月時点のPFS率はそれぞれ24.8%および10.1%であった。 全奏効率 (ORR) は、 ソトラシブ群とドセタキセル群でそれぞれ28.1%と13.2%であった。
安全性結果
ソトラシブは、 ドセタキセルと比較してグレード3以上の治療関連有害事象の発生率が低く、 忍容性は良好であった。
CodeBreaK100試験⁴⁾
NEJM. 2021 Jun 24;384(25):2371-81.
治療歴のあるNSCLC患者を対象としたソトラシブの第Ⅱ相試験結果。 全奏効率 (ORR)は36.1%であった。 奏効期間の中央値は 11.1ヵ月 (95% CI 6.9~評価不能) であった。 病勢コントロールは80.6% (95% CI 72.6~87.2) で得られた。 無増悪生存期間 (PFS) 中央値は6.8ヵ月 (95% CI 5.1~8.2)、 全生存期間 (OS) 中央値は12.5ヵ月 (95%CI 10.0~評価不能)であった。
主な有害事象
CodeBreak 200試験²⁾より引用

22か国148施設のランダム化非盲検第3相試験:掲載データを元にHOKUTO編集部で作図
参考文献
1) アムジェン株式会社. ルマケラス®︎錠 120mg 適正使用ガイド (2022年11月作成) [最終確認:2023/02/22]
*アムジェン株式会社の外部サイトへ移動します
3) 日本肺癌学会 バイオマーカー委員会. 肺癌患者におけるKRAS遺伝子G12C変異検査の手引き 第1.0版 2022.10.22 [最終確認:2023/07/27]
最終更新:2023年7月27日
和歌山県立医科大学附属病院 赤松弘朗先生
Sotorasib
Sotorasib:ソトラシブ(ルマケラス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 960mg/日 | 連日内服 | Day1~ |
その他
| 適正使用ガイドに準じて、 下痢や肝機能障害では休薬・減量を行う。 |
| 適応は、がん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCである。 |
| 2次治療以降でソトラシブ単剤療法を行うよう推奨されている (肺癌診療ガイドライン 2022年版)。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アムジェン株式会社の外部サイトへ移動します
用法・用量
通常、 成人にはソトラシブとして960mgを1日1回経口投与。 なお、 患者状態により適宜減量。
減量レベル¹⁾

休薬・減量基準¹⁾

CTCAE ver5:AST増加 / ALT増加 / 肺臓炎
レジメンの特徴と注意点
KRAS G12C変異陽性 / 2次治療以降
適応はがん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCであり、 「肺癌診療ガイドライン 2022年版」では2次治療以降でソトラシブ単剤療法を行うよう推奨されている (推奨・エビデンス 1C、 合意率67%)
KRAS活性化変異はNSCLCの25~39%に、 KRAS G12C変異は肺腺癌の13~16%に発生する²⁾

遺伝子変異とコンパニオン診断
KRASは、 RASがん遺伝子 (KRAS、HRAS、NRAS) のうちの1つである。 RASがん遺伝子は、約19%と全がん腫で最も高頻度にみられるがん遺伝子である。 欧米の肺腺がんの約30%、 日本の肺腺がんの約10%で見つかるとされる³⁾。
コンパニオン診断の最新情報について、 こちらのコンテンツを参照ください。
肺癌コンパニオン診断薬一覧ページへ遷移
使用におけるワンポイント
有害事象は主に消化器毒性と肝障害なので、 比較的使用しやすいレジメンである。 ただし、 2nd line以降で使用することになるので、 前治療で免疫チェックポイント阻害薬(ICI)が入っている場合は1か月以上空けた方がよい。
関連する臨床試験
CodeBreak 200試験²⁾
Lancet. 2023;S0140-6736(23) 00221-0.
22か国148施設のランダム化非盲検第3相試験
KRAS G12C変異を有す18歳以上のNSCLCで、 プラチナ製剤併用療法およびPD-1、 PD-L1阻害剤の前治療後に進行した患者を345名が無作為に1:1で割り付けられた (171例と174例)。
・ソトラシブ経口投与 (960mg1日1回)
・ドセタキセル静注 (75mg/m²を3週に1回)
除外:他のドライバー遺伝子変異陽性、ドセタキセル治療歴など
有効性結果
追跡期間中央値17.7ヵ月で、 無増悪生存期間 (PFS) 中央値はソトラシブ群で5.6カ月、 ドセタキセル群で4.5カ月であった (HR 0.66;p=0.002)、 12ヶ月時点のPFS率はそれぞれ24.8%および10.1%であった。 全奏効率 (ORR) は、 ソトラシブ群とドセタキセル群でそれぞれ28.1%と13.2%であった。
安全性結果
ソトラシブは、 ドセタキセルと比較してグレード3以上の治療関連有害事象の発生率が低く、 忍容性は良好であった。
CodeBreaK100試験⁴⁾
NEJM. 2021 Jun 24;384(25):2371-81.
治療歴のあるNSCLC患者を対象としたソトラシブの第Ⅱ相試験結果。 全奏効率 (ORR)は36.1%であった。 奏効期間の中央値は 11.1ヵ月 (95% CI 6.9~評価不能) であった。 病勢コントロールは80.6% (95% CI 72.6~87.2) で得られた。 無増悪生存期間 (PFS) 中央値は6.8ヵ月 (95% CI 5.1~8.2)、 全生存期間 (OS) 中央値は12.5ヵ月 (95%CI 10.0~評価不能)であった。
主な有害事象
CodeBreak 200試験²⁾より引用

22か国148施設のランダム化非盲検第3相試験:掲載データを元にHOKUTO編集部で作図
参考文献
1) アムジェン株式会社. ルマケラス®︎錠 120mg 適正使用ガイド (2022年11月作成) [最終確認:2023/02/22]
*アムジェン株式会社の外部サイトへ移動します
3) 日本肺癌学会 バイオマーカー委員会. 肺癌患者におけるKRAS遺伝子G12C変異検査の手引き 第1.0版 2022.10.22 [最終確認:2023/07/27]
最終更新:2023年7月27日
和歌山県立医科大学附属病院 赤松弘朗先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
