ポスト
臨床試験データベース
6ヶ月前
【TRICOLORE試験】大腸癌1次治療におけるFOLFOX+Bmab、 IRIS+Bmab

転移性直腸結腸癌患者の1次治療において、 IRIS療法(イリノテカン+S-1)+ベバシズマブ(Bmab)のFOLFOX/CAPOX療法+Bmabに対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
原著論文
▼解析結果
関連レジメン
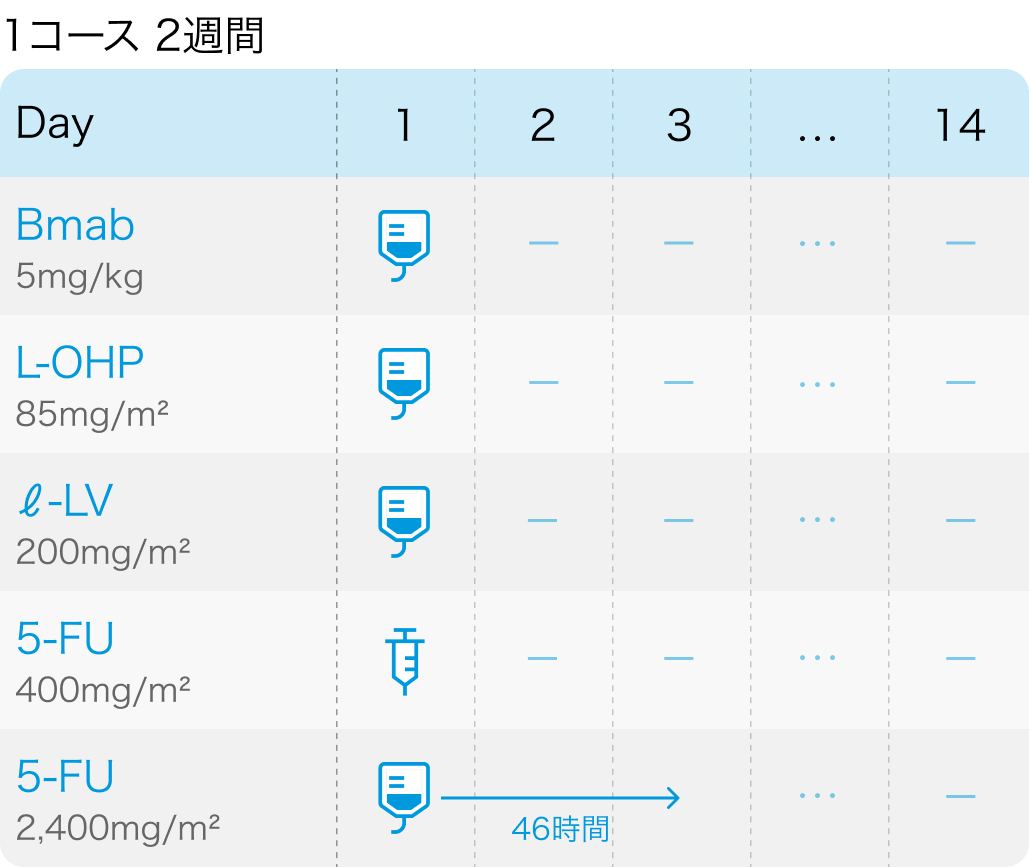
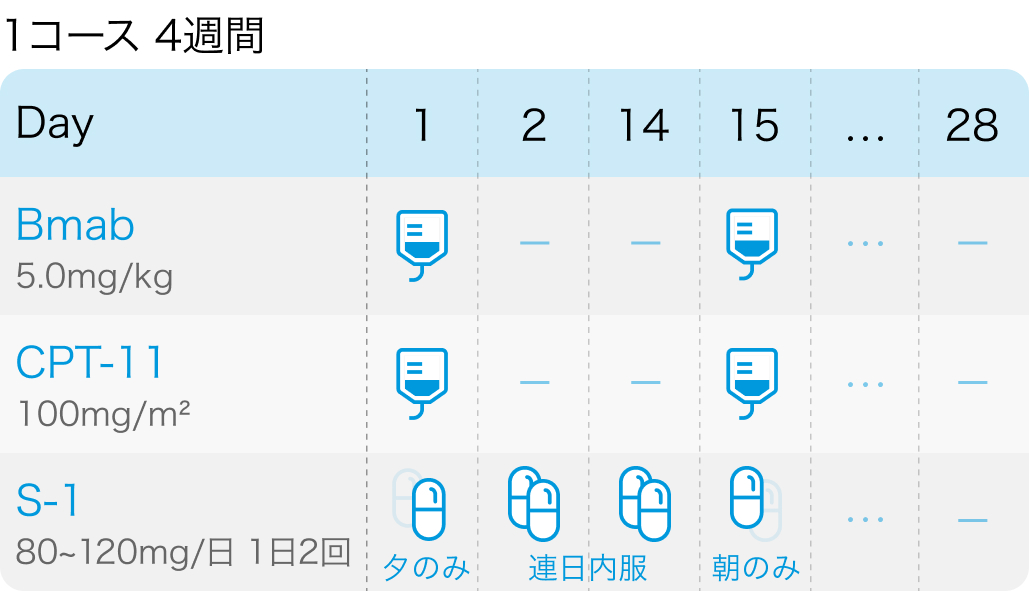
TRICOLORE試験の概要
対象
未治療の転移性直腸結腸癌の日本人患者
術後補助化学療法を完遂後、 180日以上経過した再発例を含む
方法
487例を以下の2群に1:1で割り付けた。
3例が不適格として解析対象から除外
- IRIS+Bmab群 (241例)
2種の投与方法から選択
①イリノテカン150mg/m² 点滴をDay1、 ベバシズマブ7.5mg/kg 点滴をDay1、 S-1 40mg/m² 1日2回 経口をDay1夕食後~Day15朝食後に服用し7日休薬、 3週毎に繰り返す
②イリノテカン100mg/m² 点滴をDay1,15、 ベバシズマブ5mg/kg 点滴をDay,15、 S-1 40mg/m² 1日2回 経口をDay1夕食後~Day15朝食後に服用し14日休薬、 4週毎に繰り返す
- FOLFOX / CAPOX+Bmab群 (243例)
2種の投与方法から選択
①FOLFOX:フルオロウラシル400mg/m² 急速静注をDay1+2400mg/m² 持続静注をDay1~3、 レボホリナート200mg/m² 点滴をDay1、 オキサリプラチン85mg/m² 点滴をDay1、 ベバシズマブ5mg/kg 点滴をDay1,2週毎に繰り返す
②CAPOX:オキサリプラチン130mg/m² 点滴をDay1、 ベバシズマブ7.5mg/kg 点滴をDay1、 カペシタビン 1000mg/m² 1日2回 経口をDay1夕食後~Day15朝食後に服用し7日休薬、 3週毎に繰り返す
評価項目
主要評価項目:PFS
副次評価項目:生存期間 (OS) 、 治療成功期間 (TTF) 、 奏効率、 有害事象、 QOL、 バイオマーカー解析
TRICOLORE試験の結果
患者背景 (IRIS+Bmab群、 FOLFOX/CAPOX+Bmab群)
- 年齢中央値 (64歳、 65歳)
- 65歳以上 (49.0%、 55.1%)
- ECOG PS0 (84.6%、 84.4%)
PS0、 1のみが適格
- 術後補助化学療法歴あり (13.3%、 12.8%)
- RAS変異型 (24.1%、 26.7%)
- RAS野生型 (43.6%、 40.7%)
- BRAF変異型 (4.1%、 3.7%)
- BRAF野生型 (63.1%、 63.4%)
- 腫瘍占居部位:右側 (30.3%、 29.2%)
PFS中央値
- IRIS+Bmab群:14.0ヵ月
(95%CI 12.4-15.5ヵ月)
- FOLFOX / CAPOX+Bmab群:10.8ヵ月
(95%CI 9.6-11.6ヵ月)
HR 0.84 (95%CI 0.70-1.02)、 p<0.0001
※非劣性マージンは0.25に設定 (HR1.25)
Post-Hoc解析では、 腫瘍占居部位が左側かつRAS野生型においてIRIS+Bmab群のPFSがより良好であったと報告されている。
HR 0.68 (95%CI 0.48-0.96)、 p=0.028
OS中央値
- IRIS+Bmab群:34.9ヵ月
(95%CI 31.9-42.4ヵ月)
- FOLFOX / CAPOX+Bmab群:33.6ヵ月
(95%CI 29.8-40.1ヵ月)
HR 0.86 (95%CI 0.66-1.13)、 p=0.28
TTF中央値
- IRIS+Bmab群:9.6ヵ月
(95%CI 8.2-11.0ヵ月)
- FOLFOX / CAPOX+Bmab群:7.7ヵ月
(95%CI 7.1-8.2ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
奏効率
- IRIS+Bmab群:66.4%
- FOLFOX / CAPOX+Bmab群:70.6%
p=0.34
疾患特異的QOL尺度
24週の観察期間を通して、 FACT-C TOIに差は認めなかったが、 FACT/GOG-NtxはIRIS+Bmab群で良好であった。
バイオマーカー解析
PFS、 OS共に、 RAS変異およびBRAF変異の有無による群間差は認めなかった。
有害事象 (AE)
- IRIS+Bmab群でFOLFOX/CAPOX+Bmab群に比べて多く認められたGrade3以上のAEは、 好中球減少 (24.3%vs13.6%、 p<0.01) 、 発熱性好中球減少症 (3.3%vs0%、 p<0.01) 、 下痢 (13.4%vs6.6%、 p=0.02) 、 血栓塞栓症 (3.8%vs0.8%、 p=0.04) だった。
- FOLFOX/CAPOX+Bmab群でIRIS+Bmab群に比べて多く認められたGrade 3以上のAEは、 末梢神経障害 (0%vs21.9%、 p<0.01) 、 手足症候群 (0.8%vs6.2%、 p<0.01)、麻痺性イレウス (0%vs2.9%、 p=0.02) だった。
著者らの結論
未治療の転移性直腸結腸癌患者において、 IRIS+BmabのPFSはFOLFOX/CAPOX+Bmabと比較して非劣性であり、 神経障害に関するQOLはより良好である可能性が示された。
【TRICOLORE試験】大腸癌1次治療におけるFOLFOX+Bmab、 IRIS+Bmabの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!