GC triweekly
ゲムシタビン (ジェムザール®) +シスプラチン (シスプラチン)
GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,250mg/m² 点滴 | 1~ | Day1,8 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
その他
| 1コース21日間 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
- シスプラチン (添付文書)
用法用量

投与開始基準
VESPER試験¹⁾の基準より抜粋
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18~80歳の患者で以下を満たすもの

継続基準
VESPER試験¹⁾の基準より抜粋
継続基準

サイクル1 Day8投与基準

サイクル2以降のシスプラチンの継続基準
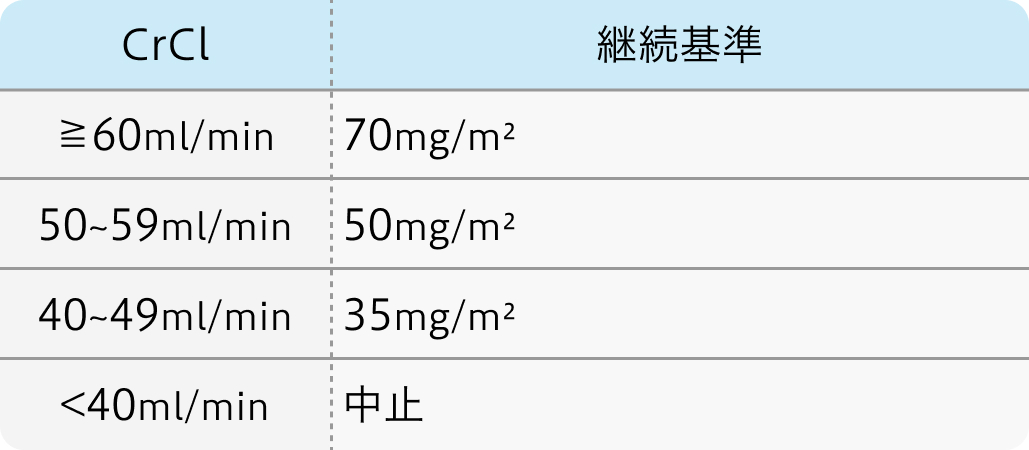
減量基準
Grade4の毒性が発生した場合、 2つの薬剤の投与量を翌サイクル以降15%減らす必要があり
好中球減少症、 脱毛症、 腎不全 (クレアチニンのクリアランスに応じたシスプラチンの投与量の調整必要)は除く
主な有害事象
有害事象データを一部引用¹⁾
主な有害事象
- 血液毒性 55%
- 無力症 4.1%
特徴と注意点
VESPER試験ではゲムシタビンの投与量が1250mg/m²であるが、 日本においての保険適応は1000mg/m²であることに注意
関連する臨床試験|VESPER試験¹⁾
筋層浸潤性尿路上皮癌患者において、 周術期のdd-MVAC療法 (メトトレキサート、 ビンブラスチン、 ドキソルビシン、 シスプラチン) の効果を、 GC療法 (ゲムシタビン、 シスプラチン) を対照に検証した第Ⅲ相比較試験VESPERの結果より、 術前化学療法として行った際の3年時の無増悪生存期間 (PFS) に対する有益性が示された。
3年時のPFS率
全患者
- dd-MVAC群:64%
- GC群:56%
HR 0.77 (95%CI 0.57-1.02)、 p=0.066
術前化学療法
- dd-MVAC群:66%
- GC群:56%
HR 0.70 (95%CI 0.51-0.96)、 p=0.025
術前化学療法後に膀胱摘出術を受けた患者における、 3年時PFS率の多変量解析
- ypTis、 Ta、 T1およびypN0の患者 vs pCRの患者
HR 1.13 (95%CI 0.53-2.39)
- ypT2N0 vs pCR
HR 2.61 (95%CI 1.38-4.95)
- ypt≧3またはypN+ vs pCR
HR 10.3 (95%CI 6.37-16.8)
3年時のTTP率
全患者
- dd-MVAC群:69%
- GC群:58%
HR 0.68 (95%CI 0.50-0.93)、 p=0.014
術前化学療法
- dd-MVAC群:71%
- GC群:59%
HR 0.62 (95%CI 0.44-0.85)、 p=0.005
OS
5年間の追跡調査後に報告される予定
関連する臨床試験|POUT試験²⁾
根治的腎尿管全摘除術後の上部尿路癌患者において、 ゲムシタビンとプラチナ製剤の併用化学療法 (GC療法) の効果を、 術後補助化学療法を行わないサーベイランス群を対照に検証した第Ⅲ相比較試験POUTの結果より、 無病生存期間 (DFS) に対する有益性が示された。
DFS中央値
- GC群:未到達
- サーベイランス群:29.8ヵ月
(95%CI 13.6ヵ月-未到達)
HR 0.45 (95%CI 0.30-0.68)、 p=0.0001
3年時のDFS率
- GC群:71%
(95%CI 61-78%)
- サーベイランス群:46%
(95%CI 36-56%)
MFS
GC群で有意に長かった。
HR 0.48 (95%CI 0.31-0.74)、 p=0.0007
3年時のMFS率
- GC群:71%
(95%CI 60-79%)
- サーベイランス群:53%
(95%CI 42-63%)
参考文献
- Dose-Dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients With Nonmetastatic Muscle-Invasive Bladder Cancer: Results of the GETUG-AFU V05 VESPER Trial. J Clin Oncol. 2022 Jun 20;40(18):2013-2022. PMID: 35254888
- Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomised controlled trial. Lancet. 2020 Apr 18;395(10232):1268-1277. PMID: 32145825
最終更新日:2023年9月22日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
GC triweekly
GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,250mg/m² 点滴 | 1~ | Day1,8 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
その他
| 1コース21日間 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
- シスプラチン (添付文書)
用法用量

投与開始基準
VESPER試験¹⁾の基準より抜粋
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18~80歳の患者で以下を満たすもの

継続基準
VESPER試験¹⁾の基準より抜粋
継続基準

サイクル1 Day8投与基準

サイクル2以降のシスプラチンの継続基準

減量基準
Grade4の毒性が発生した場合、 2つの薬剤の投与量を翌サイクル以降15%減らす必要があり
好中球減少症、 脱毛症、 腎不全 (クレアチニンのクリアランスに応じたシスプラチンの投与量の調整必要)は除く
主な有害事象
有害事象データを一部引用¹⁾
主な有害事象
- 血液毒性 55%
- 無力症 4.1%
特徴と注意点
VESPER試験ではゲムシタビンの投与量が1250mg/m²であるが、 日本においての保険適応は1000mg/m²であることに注意
関連する臨床試験|VESPER試験¹⁾
筋層浸潤性尿路上皮癌患者において、 周術期のdd-MVAC療法 (メトトレキサート、 ビンブラスチン、 ドキソルビシン、 シスプラチン) の効果を、 GC療法 (ゲムシタビン、 シスプラチン) を対照に検証した第Ⅲ相比較試験VESPERの結果より、 術前化学療法として行った際の3年時の無増悪生存期間 (PFS) に対する有益性が示された。
3年時のPFS率
全患者
- dd-MVAC群:64%
- GC群:56%
HR 0.77 (95%CI 0.57-1.02)、 p=0.066
術前化学療法
- dd-MVAC群:66%
- GC群:56%
HR 0.70 (95%CI 0.51-0.96)、 p=0.025
術前化学療法後に膀胱摘出術を受けた患者における、 3年時PFS率の多変量解析
- ypTis、 Ta、 T1およびypN0の患者 vs pCRの患者
HR 1.13 (95%CI 0.53-2.39)
- ypT2N0 vs pCR
HR 2.61 (95%CI 1.38-4.95)
- ypt≧3またはypN+ vs pCR
HR 10.3 (95%CI 6.37-16.8)
3年時のTTP率
全患者
- dd-MVAC群:69%
- GC群:58%
HR 0.68 (95%CI 0.50-0.93)、 p=0.014
術前化学療法
- dd-MVAC群:71%
- GC群:59%
HR 0.62 (95%CI 0.44-0.85)、 p=0.005
OS
5年間の追跡調査後に報告される予定
関連する臨床試験|POUT試験²⁾
根治的腎尿管全摘除術後の上部尿路癌患者において、 ゲムシタビンとプラチナ製剤の併用化学療法 (GC療法) の効果を、 術後補助化学療法を行わないサーベイランス群を対照に検証した第Ⅲ相比較試験POUTの結果より、 無病生存期間 (DFS) に対する有益性が示された。
DFS中央値
- GC群:未到達
- サーベイランス群:29.8ヵ月
(95%CI 13.6ヵ月-未到達)
HR 0.45 (95%CI 0.30-0.68)、 p=0.0001
3年時のDFS率
- GC群:71%
(95%CI 61-78%)
- サーベイランス群:46%
(95%CI 36-56%)
MFS
GC群で有意に長かった。
HR 0.48 (95%CI 0.31-0.74)、 p=0.0007
3年時のMFS率
- GC群:71%
(95%CI 60-79%)
- サーベイランス群:53%
(95%CI 42-63%)
参考文献
- Dose-Dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients With Nonmetastatic Muscle-Invasive Bladder Cancer: Results of the GETUG-AFU V05 VESPER Trial. J Clin Oncol. 2022 Jun 20;40(18):2013-2022. PMID: 35254888
- Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomised controlled trial. Lancet. 2020 Apr 18;395(10232):1268-1277. PMID: 32145825
最終更新日:2023年9月22日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
