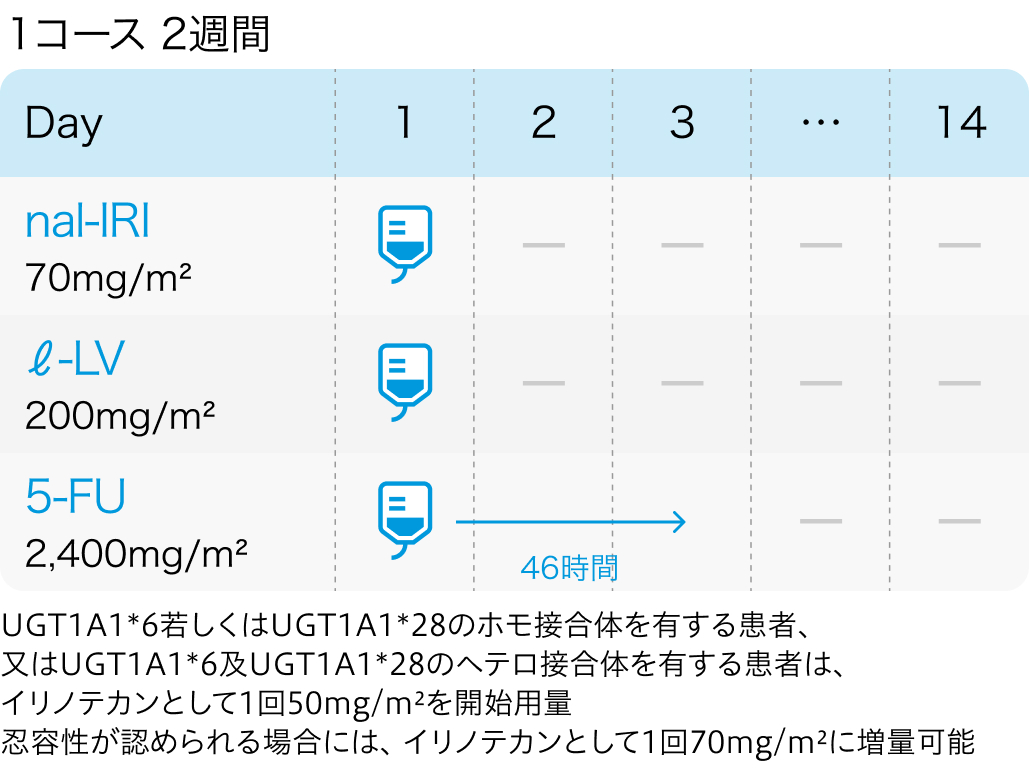
Nal-IRI+5-FU/LV
ナノリポソーム型イリノテカン+フルオロウラシル+レボホリナートカルシウム
nal-IRI:ナノリポソーム型イリノテカン(オニバイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本セルヴィエ株式会社の外部サイトへ遷移します
用法用量
投与開始基準
投与予定日に確認し、 当該条件を満たす状態へ回復するまで投与を延期

減量基準

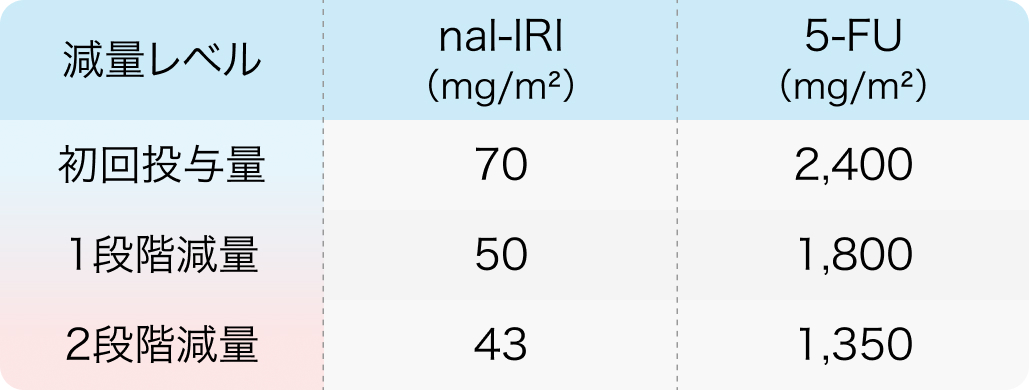
初回基準量と減量レベル
UGT1A1*6若しくはUGT1A1*28のホモ接合体を有さない患者、 並びにUGT1A1*6及びUGT1A1*28のヘテロ接合体を有さない患者
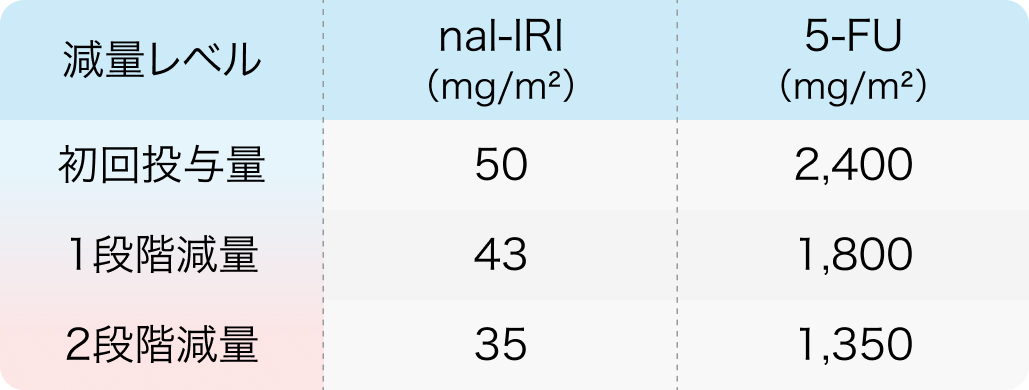
UGT1A1*6若しくはUGT1A1*28のホモ接合体を有する患者、 又はUGT1A1*6及びUGT1A1*28のヘテロ接合体を有する患者
忍容性が良好で70mg/m2に増量された場合の用量調節は、 「UGT1A1*6若しくはUGT1A1*28のホモ接合体を有さない患者、 並びにUGT1A1*6及びUGT1A1*28のヘテロ接合体を有さない患者」 の表に従うこと。
主な有害事象
331501試験¹⁾
日本人を対象とした試験の有害事象データを一部引用
主な有害事象
- 好中球数減少 63.0%
- 白血球数減少 60.9%
- 貧血 19.6%
- 好中球減少 10.9%
- 悪心 78.3%
- 食欲減退 60.9%
- 下痢 56.5%
- 倦怠感 26.1%
- 嘔吐 23.9%
- 疲労 23.9%
- 発熱 19.6%
- 便秘 17.4%
- 口内炎 17.4%
上手に使うためのワンポイント
UGT1A1遺伝子多型検査の必要性
本レジメン投与前にUGT1A1遺伝子多型検査が必要であるが、 結果が得られるまでに1週間前後かかるため、 開始時に結果が得られているよう一次治療中に検査をしておく。
副作用 (便秘・下痢) の対策
副作用として下痢が多く認められるがNal-IRIによる下痢は、 早発型 (投与中あるいは投与直後) と遅発型 (投与後24時間以降)に分けられる。 早発型はコリン作動性と考えられ、 ブチルスコポラミンなどの抗コリン薬で対応する。 遅発型はイリノテカンの活性代謝物であるSN-38による腸管粘膜障害と考えられロペラミドなどで対応する。
一方、 便秘をするとSN-38の再吸収が増加し、 毒性が強くなる可能性があるため、 便秘にならないよう注意し、 場合によっては下剤を処方し対応することも重要である。
特徴と注意点
Nal-IRIの特徴
Nal-IRIはイリノテカンをリポソーム化した製剤で、 イリノテカンの腫瘍組織への分布増加・血中循環時間の延長により抗腫瘍活性の増強が図られている。
またイリノテカン同様、 Nal-IRIは胆汁排泄性であるため、 閉塞性黄疸など、 血中ビリルビンが高値の場合の投与は避ける。
NAPOLI-1試験²⁾と331501試験¹⁾の結果
海外で行われた第Ⅲ相試験 (NAPOLI-1試験) ²⁾では、 5-FU/LV群と比較してNal-IRI+5-FU/LV群において、 全生存期間および無増悪期間が有意に優れていた。
また国内でも日本人に対する有効性、 安全性および薬物動態を検討する第Ⅱ相試験 (331501試験) ¹⁾が実施され、 5-FU/LV群と比較してNal-IRI+5-FU/LV群において、 NAPOLI-1試験と同様に無増悪生存期間が優れていた。
遺伝子型による好中球減少への影響
UGT1A1遺伝子が*6または*28のホモ接合体、 *6と*28のヘテロ接合体のいずれかの患者においては好中球減少が強く発現する可能性があり、 Nal-IRIの開始用量を70mg/m²から50mg/m²に減量し投与開始する。 ただし、 忍容性が良好な場合は、 2サイクル目以降の投与を70mg/m²として投与することも可能である。
関連する臨床試験|①331501試験¹⁾
ゲムシタビンを含む化学療法後に増悪した遠隔転移を有する日本人膵癌患者に対するNal-IRI+5-FU/l-LV併用投与の有効性、 安全性及び薬物動態を検討するための国内第Ⅱ相試験。 20歳以上の膵癌患者を対象に実施された。
*日本セルヴィエ株式会社の外部サイトへ遷移します
関連する臨床試験|②NAPOLI-1試験²⁾
ゲムシタビンベースの治療歴のある転移性膵管腺癌患者において、 ナノリポソーム化イリノテカン (Nal-IRI) 、 フルオロウラシル (5-FU) 、 ロイコボリン (LV) の併用療法とNal-IRIの単剤療法を、 5FU/LVの併用療法を対照に検証した第Ⅲ相ランダム化比較試験NAPOLI-1の結果より、 Nal-IRI+5-FU/LV併用療法の全生存期間 (OS) に対する有効性が示された。
OS中央値
- Nal-IRI+5-FU/LV群:6.2ヵ月
(95%CI 4.8-8.4ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.3-5.3ヵ月)
HR 0.75、 p=0.039
- Nal-IRI単剤群:4.9ヵ月
(95%CI 4.2-5.6ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.6-4.9ヵ月)
HR 1.07、 p=0.568
OS率 (6ヵ月時、 12ヵ月時)
- Nal-IRI+5-FU/LV群:53%、 26%
- Nal-IRI単剤群:39%、 11%
- 5-FU/LV対照群:35%、 15%
PFS中央値
- Nal-IRI+5-FU/LV群:3.1ヵ月
(95%CI 2.7-4.2ヵ月)
- 5-FU/LV対照群:1.5ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.57、 p=0.0001
- Nal-IRI単剤群:2.7ヵ月
(95%CI 2.1-2.9ヵ月)
- 5-FU/LV対照群:1.6ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.81、 p=0.105
TTF中央値
- Nal-IRI+5-FU/LV群:2.3ヵ月
(95%CI 1.6-2.8ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.6 (95%CI 0.45-0.78)、 p=0.0002
- Nal-IRI単剤群:1.7ヵ月
(95%CI 1.5-2.7ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.82 (95%CI 0.65-1.03)、 p=0.1
ORR
- Nal-IRI+5-FU/LV群:17%
(95%CI 10-24%)
- 5-FU/LV対照群:1%
(95%CI 0-2%)
p<0.0001
- Nal-IRI単剤群:6%
(95%CI 3-11%)
- 5-FU/LV対照群:1%
(95%CI 0-4%)
p=0.020
病勢コントロール率
- Nal-IRI+5-FU/LV群:52%
(95%CI 43-61%)
- Nal-IRI単剤群:44%
(95%CI 36-52%)
- 5-FU/LV対照群:26%
(95%CI 19-33%)
CA19-9奏効率
- Nal-IRI+5-FU/LV群:29%
- 5-FU/LV対照群:9%
p=0.0006
- Nal-IRI単剤群:24%
- 5-FU/LV対照群:11%
p=0.024
出典
- 日本セルヴィエ株式会社. 「オニバイド®適正使用ガイド」 [最終閲覧2023/04/18]
- Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet. 2016 Feb 6;387(10018):545-557. PMID: 26615328
最終更新日:2023年12月13日
執筆医:神奈川県立がんセンター 消化器内科 朝井 靖二先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
Nal-IRI+5-FU/LV
nal-IRI:ナノリポソーム型イリノテカン(オニバイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本セルヴィエ株式会社の外部サイトへ遷移します
用法用量

投与開始基準
投与予定日に確認し、 当該条件を満たす状態へ回復するまで投与を延期

減量基準

初回基準量と減量レベル
UGT1A1*6若しくはUGT1A1*28のホモ接合体を有さない患者、 並びにUGT1A1*6及びUGT1A1*28のヘテロ接合体を有さない患者

UGT1A1*6若しくはUGT1A1*28のホモ接合体を有する患者、 又はUGT1A1*6及びUGT1A1*28のヘテロ接合体を有する患者
忍容性が良好で70mg/m2に増量された場合の用量調節は、 「UGT1A1*6若しくはUGT1A1*28のホモ接合体を有さない患者、 並びにUGT1A1*6及びUGT1A1*28のヘテロ接合体を有さない患者」 の表に従うこと。

主な有害事象
331501試験¹⁾
日本人を対象とした試験の有害事象データを一部引用
主な有害事象
- 好中球数減少 63.0%
- 白血球数減少 60.9%
- 貧血 19.6%
- 好中球減少 10.9%
- 悪心 78.3%
- 食欲減退 60.9%
- 下痢 56.5%
- 倦怠感 26.1%
- 嘔吐 23.9%
- 疲労 23.9%
- 発熱 19.6%
- 便秘 17.4%
- 口内炎 17.4%
上手に使うためのワンポイント
UGT1A1遺伝子多型検査の必要性
本レジメン投与前にUGT1A1遺伝子多型検査が必要であるが、 結果が得られるまでに1週間前後かかるため、 開始時に結果が得られているよう一次治療中に検査をしておく。
副作用 (便秘・下痢) の対策
副作用として下痢が多く認められるがNal-IRIによる下痢は、 早発型 (投与中あるいは投与直後) と遅発型 (投与後24時間以降)に分けられる。 早発型はコリン作動性と考えられ、 ブチルスコポラミンなどの抗コリン薬で対応する。 遅発型はイリノテカンの活性代謝物であるSN-38による腸管粘膜障害と考えられロペラミドなどで対応する。
一方、 便秘をするとSN-38の再吸収が増加し、 毒性が強くなる可能性があるため、 便秘にならないよう注意し、 場合によっては下剤を処方し対応することも重要である。
特徴と注意点
Nal-IRIの特徴
Nal-IRIはイリノテカンをリポソーム化した製剤で、 イリノテカンの腫瘍組織への分布増加・血中循環時間の延長により抗腫瘍活性の増強が図られている。
またイリノテカン同様、 Nal-IRIは胆汁排泄性であるため、 閉塞性黄疸など、 血中ビリルビンが高値の場合の投与は避ける。
NAPOLI-1試験²⁾と331501試験¹⁾の結果
海外で行われた第Ⅲ相試験 (NAPOLI-1試験) ²⁾では、 5-FU/LV群と比較してNal-IRI+5-FU/LV群において、 全生存期間および無増悪期間が有意に優れていた。
また国内でも日本人に対する有効性、 安全性および薬物動態を検討する第Ⅱ相試験 (331501試験) ¹⁾が実施され、 5-FU/LV群と比較してNal-IRI+5-FU/LV群において、 NAPOLI-1試験と同様に無増悪生存期間が優れていた。
遺伝子型による好中球減少への影響
UGT1A1遺伝子が*6または*28のホモ接合体、 *6と*28のヘテロ接合体のいずれかの患者においては好中球減少が強く発現する可能性があり、 Nal-IRIの開始用量を70mg/m²から50mg/m²に減量し投与開始する。 ただし、 忍容性が良好な場合は、 2サイクル目以降の投与を70mg/m²として投与することも可能である。
関連する臨床試験|①331501試験¹⁾
ゲムシタビンを含む化学療法後に増悪した遠隔転移を有する日本人膵癌患者に対するNal-IRI+5-FU/l-LV併用投与の有効性、 安全性及び薬物動態を検討するための国内第Ⅱ相試験。 20歳以上の膵癌患者を対象に実施された。
*日本セルヴィエ株式会社の外部サイトへ遷移します
関連する臨床試験|②NAPOLI-1試験²⁾
ゲムシタビンベースの治療歴のある転移性膵管腺癌患者において、 ナノリポソーム化イリノテカン (Nal-IRI) 、 フルオロウラシル (5-FU) 、 ロイコボリン (LV) の併用療法とNal-IRIの単剤療法を、 5FU/LVの併用療法を対照に検証した第Ⅲ相ランダム化比較試験NAPOLI-1の結果より、 Nal-IRI+5-FU/LV併用療法の全生存期間 (OS) に対する有効性が示された。
OS中央値
- Nal-IRI+5-FU/LV群:6.2ヵ月
(95%CI 4.8-8.4ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.3-5.3ヵ月)
HR 0.75、 p=0.039
- Nal-IRI単剤群:4.9ヵ月
(95%CI 4.2-5.6ヵ月)
- 5-FU/LV対照群:4.2ヵ月
(95%CI 3.6-4.9ヵ月)
HR 1.07、 p=0.568
OS率 (6ヵ月時、 12ヵ月時)
- Nal-IRI+5-FU/LV群:53%、 26%
- Nal-IRI単剤群:39%、 11%
- 5-FU/LV対照群:35%、 15%
PFS中央値
- Nal-IRI+5-FU/LV群:3.1ヵ月
(95%CI 2.7-4.2ヵ月)
- 5-FU/LV対照群:1.5ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.57、 p=0.0001
- Nal-IRI単剤群:2.7ヵ月
(95%CI 2.1-2.9ヵ月)
- 5-FU/LV対照群:1.6ヵ月
(95%CI 1.4-1.8ヵ月)
HR 0.81、 p=0.105
TTF中央値
- Nal-IRI+5-FU/LV群:2.3ヵ月
(95%CI 1.6-2.8ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.6 (95%CI 0.45-0.78)、 p=0.0002
- Nal-IRI単剤群:1.7ヵ月
(95%CI 1.5-2.7ヵ月)
- 5-FU/LV対照群:1.4ヵ月
(95%CI 1.3-1.4ヵ月)
HR 0.82 (95%CI 0.65-1.03)、 p=0.1
ORR
- Nal-IRI+5-FU/LV群:17%
(95%CI 10-24%)
- 5-FU/LV対照群:1%
(95%CI 0-2%)
p<0.0001
- Nal-IRI単剤群:6%
(95%CI 3-11%)
- 5-FU/LV対照群:1%
(95%CI 0-4%)
p=0.020
病勢コントロール率
- Nal-IRI+5-FU/LV群:52%
(95%CI 43-61%)
- Nal-IRI単剤群:44%
(95%CI 36-52%)
- 5-FU/LV対照群:26%
(95%CI 19-33%)
CA19-9奏効率
- Nal-IRI+5-FU/LV群:29%
- 5-FU/LV対照群:9%
p=0.0006
- Nal-IRI単剤群:24%
- 5-FU/LV対照群:11%
p=0.024
出典
- 日本セルヴィエ株式会社. 「オニバイド®適正使用ガイド」 [最終閲覧2023/04/18]
- Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet. 2016 Feb 6;387(10018):545-557. PMID: 26615328
最終更新日:2023年12月13日
執筆医:神奈川県立がんセンター 消化器内科 朝井 靖二先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。


