S-1 (Adj)
テガフール・ギメラシル・オテラシル (ティーエスワン®)
治療スケジュール
概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ティーエスワン® (添付文書)
用法用量
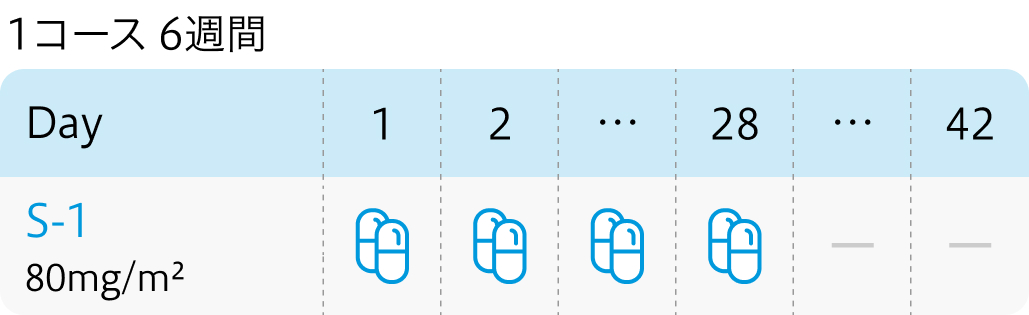
投与開始基準
PIECE試験¹⁾より抜粋
20~75歳の臨床ステージIB-IIIの局所進行性食道扁平上皮がん (ESCC)と診断され、 PSが0または1の患者。
主な有害事象
PIECE試験¹⁾
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球減少症 13.2%
- 食欲不振 13.2%
- 下痢 10.5%
上手に使うためのワンポイント
- Adj. S-1療法は52例の単群の第II相試験で評価されており、 比較試験でないため現時点では標準治療に至っていない¹⁾。
- neoCF療法やneoDCF療法後に考慮されるが、 無治療に対する優越性が占められておらず、 またAdj. Nivo療法との使い分けも現時点では不明である。
- 術前化学療法後のAdj. Nivo療法、 Adj S1療法、 無治療との3群を比較したJCOG2206試験が行われており同試験の結果が待たれる。
特徴と注意点
- S-1の投与法に関しては胃癌や膵癌と同様に4投2休 (1コース6週間) となっているが、 胃癌とは異なり4コースで終了する。
- S-1に関しては一部に消化器症状などにより不耐の症例が存在するため、 開始1週間後には有害事象を確認する。 3週間目以降に有害事象により継続困難となる症例に関しては2投1休へのスケジュール調整を検討する。 2週以内に有害事象により継続困難となる症例については減量を検討する。
- S-1は涙道や角膜障害により流涙を来すため、 防腐剤を含まない人工涙液によるWash out を予防的に行う。 症状が悪化すれば眼科医へコンサルトする。
関連する臨床試験|PIECE試験¹⁾
術前化学療法後の切除可能な局所進行食道扁平上皮癌患者の術後療法において、 S-1の効果を検証した単群コホートの第Ⅱ相試験PIECEの結果より、 S-1投与の安全性と有効性が示された。
3年RFS率
72.3%
(90%CI 59.9-81.5%)
3年OS率
85.0%
(90%CI 73.9-91.6%)
参考文献
*Journal of Clinical Oncologyの外部サイトに遷移
最終更新日:2023年12月18日
監修医師:HOKUTO編集部監修医師
S-1 (Adj)
テガフール・ギメラシル・オテラシル (ティーエスワン®)
2024年02月09日更新
S-1:テガフール・ギメラシル・オテラシル(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/日 経口 分2 朝夕食後 | 1~ | Day1~28 |
その他
| 1コース42日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ティーエスワン® (添付文書)
用法用量

投与開始基準
PIECE試験¹⁾より抜粋
20~75歳の臨床ステージIB-IIIの局所進行性食道扁平上皮がん (ESCC)と診断され、 PSが0または1の患者。
主な有害事象
PIECE試験¹⁾
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球減少症 13.2%
- 食欲不振 13.2%
- 下痢 10.5%
上手に使うためのワンポイント
- Adj. S-1療法は52例の単群の第II相試験で評価されており、 比較試験でないため現時点では標準治療に至っていない¹⁾。
- neoCF療法やneoDCF療法後に考慮されるが、 無治療に対する優越性が占められておらず、 またAdj. Nivo療法との使い分けも現時点では不明である。
- 術前化学療法後のAdj. Nivo療法、 Adj S1療法、 無治療との3群を比較したJCOG2206試験が行われており同試験の結果が待たれる。
特徴と注意点
- S-1の投与法に関しては胃癌や膵癌と同様に4投2休 (1コース6週間) となっているが、 胃癌とは異なり4コースで終了する。
- S-1に関しては一部に消化器症状などにより不耐の症例が存在するため、 開始1週間後には有害事象を確認する。 3週間目以降に有害事象により継続困難となる症例に関しては2投1休へのスケジュール調整を検討する。 2週以内に有害事象により継続困難となる症例については減量を検討する。
- S-1は涙道や角膜障害により流涙を来すため、 防腐剤を含まない人工涙液によるWash out を予防的に行う。 症状が悪化すれば眼科医へコンサルトする。
関連する臨床試験|PIECE試験¹⁾
術前化学療法後の切除可能な局所進行食道扁平上皮癌患者の術後療法において、 S-1の効果を検証した単群コホートの第Ⅱ相試験PIECEの結果より、 S-1投与の安全性と有効性が示された。
3年RFS率
72.3%
(90%CI 59.9-81.5%)
3年OS率
85.0%
(90%CI 73.9-91.6%)
参考文献
*Journal of Clinical Oncologyの外部サイトに遷移
最終更新日:2023年12月18日
監修医師:HOKUTO編集部監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
