Pazopanib
パゾパニブ (ヴォトリエント®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヴォトリエント® (添付文書)
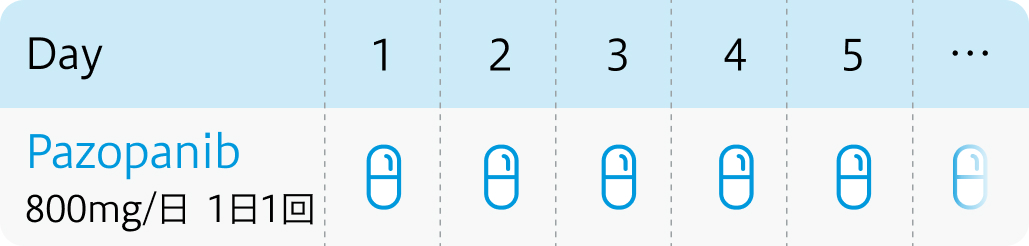
用法用量 (連日投与)
投与開始基準
COMPARZ試験¹⁾の基準より抜粋
淡明細胞型腎細胞がんの組織学的または細胞学的診断ある18歳以上の患者で以下を満たすもの

減量・休薬・中止基準

※①肝不全、 肝機能障害、 ②高血圧、高血圧クリーゼ、 ③心機能障害、 ④QT間隔延長、 心室性不整脈は以下を参照
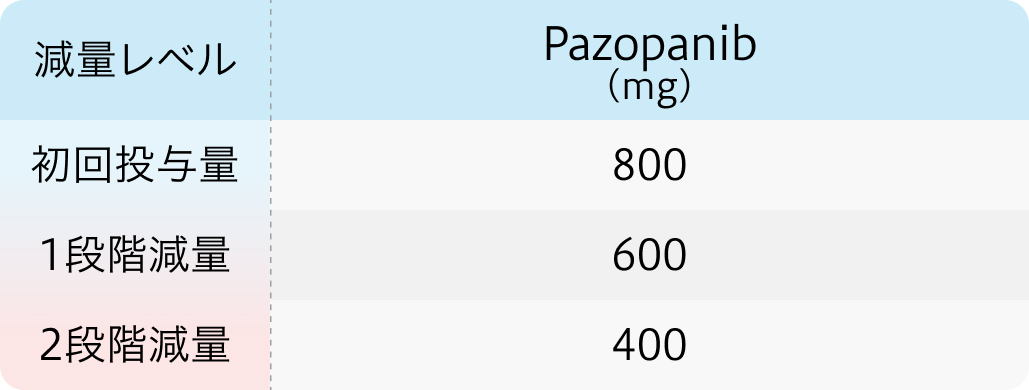
初回基準量と減量レベル
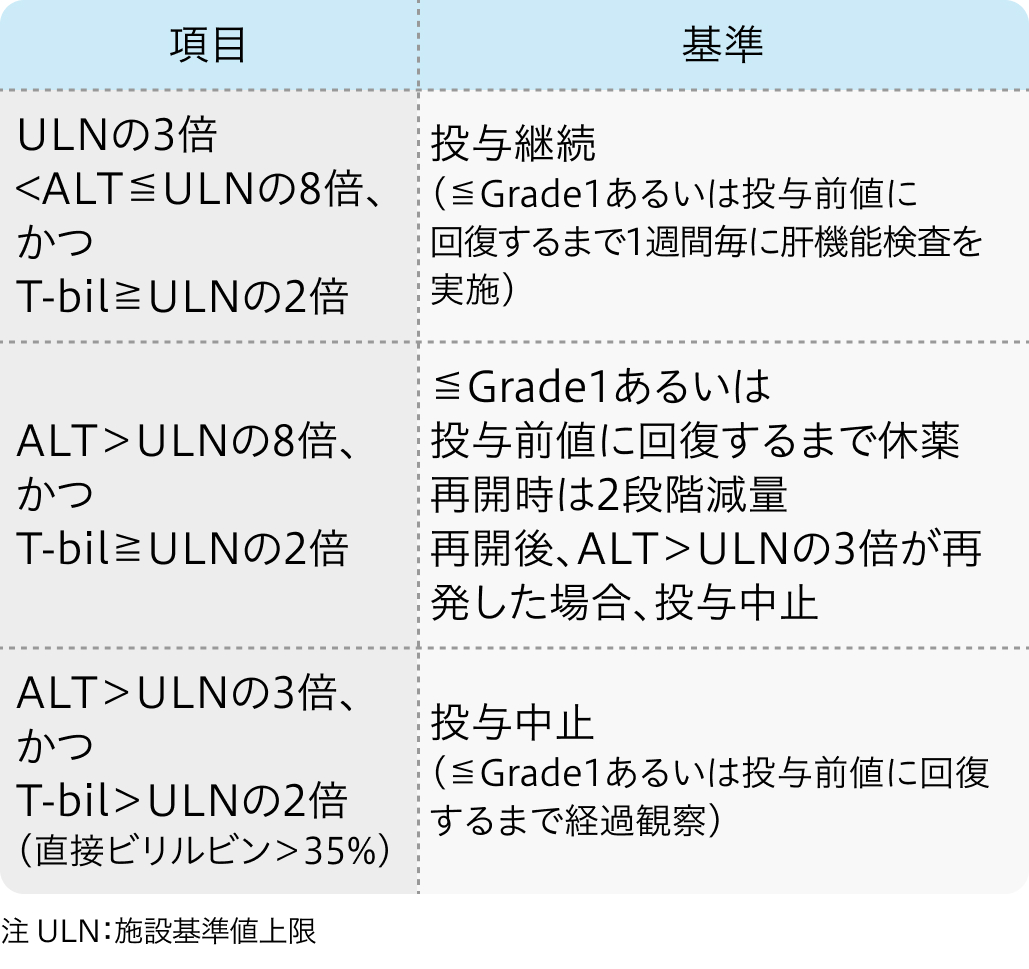
①肝機能検査値異常に対する減量・休薬・中止基準
②高血圧に対する減量・休薬・中止基準

③心機能障害に対する減量・休薬・中止基準

④QT間隔延長に対する減量・休薬・中止基準

主な有害事象
COMPARZ試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 血小板減少症 82.1% (17.9%)
- リンパ球減少症 61.5% (5.1%)
- 白血球減少症 59.0% (7.7%)
- 好中球減少症 51.3% (7.7%)
- AST上昇 46.2% (2.6%)
- ALT上昇 46.2% (2.6%)
- 貧血 48.7% (0%)
- 倦怠感 54.5% (10.6%)
- 便秘 17.0% (0.7%)
- 体重減少 15.2% (0.9%)
- 粘膜炎症 11.0% (0.5%)
- 発熱 8.7% (0.4%)
注意すべき有害事象
- 手足症候群 82.1% (5.1%)
特徴と注意点
スニチニブと比較して手足症候群や疲労、 口腔粘膜炎が少ないが、 肝機能障害は多い。 肝機能障害は致死的となることもあるため、 投与初期にはとくに注意深く血液検査でフォローする。
関連する臨床試験|COMPARZ試験¹⁾
未治療で転移性の淡明細胞型腎細胞癌患者において、 初回治療としてのマルチキナーゼ阻害薬パゾパニブとスニチニブの有効性と安全性を比較した第Ⅲ相試験COMPARZの結果より、 スニチニブに対するパゾパニブの無増悪生存期間 (PFS) の非劣性が示された。
PFS中央値
- パゾパニブ群:8.4ヵ月
(95%CI 8.3-10.9ヵ月)
- スニチニブ群:9.5ヵ月
(95%CI 8.3-11.1ヵ月)
HR 1.05 (95%CI 0.90-1.22)
ORR
- パゾパニブ群:31%
(95%CI 26.9-34.5%)
- スニチニブ群:25%
(95%CI 21.1-28.4%)
OS中央値
- パゾパニブ群 28.4ヵ月
(95%CI 26.2-35.6ヵ月)
- スニチニブ群 29.3ヵ月
(95%CI 25.3-32.5ヵ月)
HR 0.91 (95%CI 0.76-1.08)
参考文献
最終更新日:2023年10月19日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Pazopanib
Pazopanib:パゾパニブ(ヴォトリエント®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg 経口1日1回 | 1~ | 連日投与 |
その他
| 連日投与。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヴォトリエント® (添付文書)
用法用量 (連日投与)

投与開始基準
COMPARZ試験¹⁾の基準より抜粋
淡明細胞型腎細胞がんの組織学的または細胞学的診断ある18歳以上の患者で以下を満たすもの

減量・休薬・中止基準

※①肝不全、 肝機能障害、 ②高血圧、高血圧クリーゼ、 ③心機能障害、 ④QT間隔延長、 心室性不整脈は以下を参照
初回基準量と減量レベル

①肝機能検査値異常に対する減量・休薬・中止基準

②高血圧に対する減量・休薬・中止基準

③心機能障害に対する減量・休薬・中止基準

④QT間隔延長に対する減量・休薬・中止基準

主な有害事象
COMPARZ試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 血小板減少症 82.1% (17.9%)
- リンパ球減少症 61.5% (5.1%)
- 白血球減少症 59.0% (7.7%)
- 好中球減少症 51.3% (7.7%)
- AST上昇 46.2% (2.6%)
- ALT上昇 46.2% (2.6%)
- 貧血 48.7% (0%)
- 倦怠感 54.5% (10.6%)
- 便秘 17.0% (0.7%)
- 体重減少 15.2% (0.9%)
- 粘膜炎症 11.0% (0.5%)
- 発熱 8.7% (0.4%)
注意すべき有害事象
- 手足症候群 82.1% (5.1%)
特徴と注意点
スニチニブと比較して手足症候群や疲労、 口腔粘膜炎が少ないが、 肝機能障害は多い。 肝機能障害は致死的となることもあるため、 投与初期にはとくに注意深く血液検査でフォローする。
関連する臨床試験|COMPARZ試験¹⁾
未治療で転移性の淡明細胞型腎細胞癌患者において、 初回治療としてのマルチキナーゼ阻害薬パゾパニブとスニチニブの有効性と安全性を比較した第Ⅲ相試験COMPARZの結果より、 スニチニブに対するパゾパニブの無増悪生存期間 (PFS) の非劣性が示された。
PFS中央値
- パゾパニブ群:8.4ヵ月
(95%CI 8.3-10.9ヵ月)
- スニチニブ群:9.5ヵ月
(95%CI 8.3-11.1ヵ月)
HR 1.05 (95%CI 0.90-1.22)
ORR
- パゾパニブ群:31%
(95%CI 26.9-34.5%)
- スニチニブ群:25%
(95%CI 21.1-28.4%)
OS中央値
- パゾパニブ群 28.4ヵ月
(95%CI 26.2-35.6ヵ月)
- スニチニブ群 29.3ヵ月
(95%CI 25.3-32.5ヵ月)
HR 0.91 (95%CI 0.76-1.08)
参考文献
最終更新日:2023年10月19日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
