T-DM1
トラスツズマブ エムタンシン
概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
用法用量

前投薬
軽度催吐性リスクのため、 デキサメタゾン注を6.6mg前投与する。
投与開始基準
EMILIA試験¹⁾より抜粋
タキサン系薬剤とトラスツズマブによる前治療歴のある切除不能な局所進行性または転移性HER2陽性乳癌の以下に該当する患者
- PS0-1
- 左室駆出率が≧50%以上
減量・休薬・中止基準
HER2陽性の手術不能又は再発乳癌
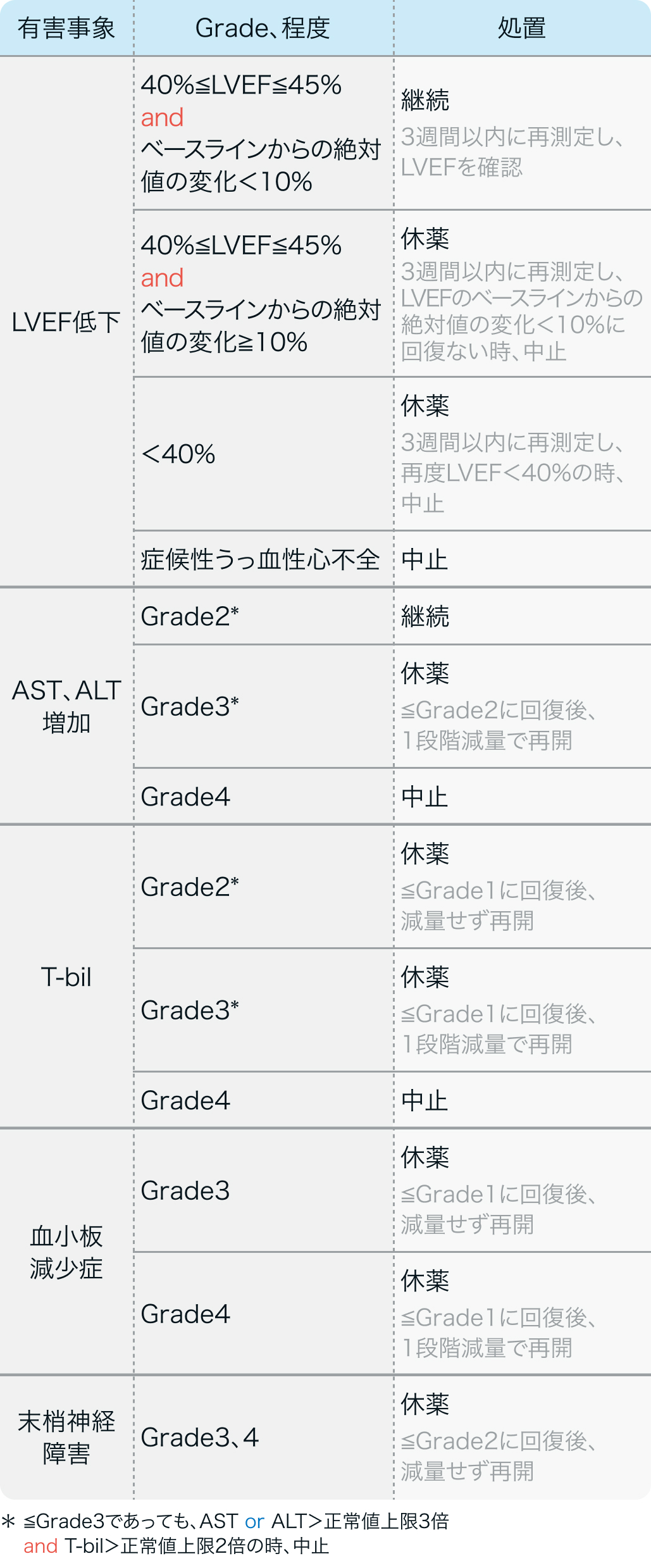
HER2陽性の乳癌における術後薬物療法
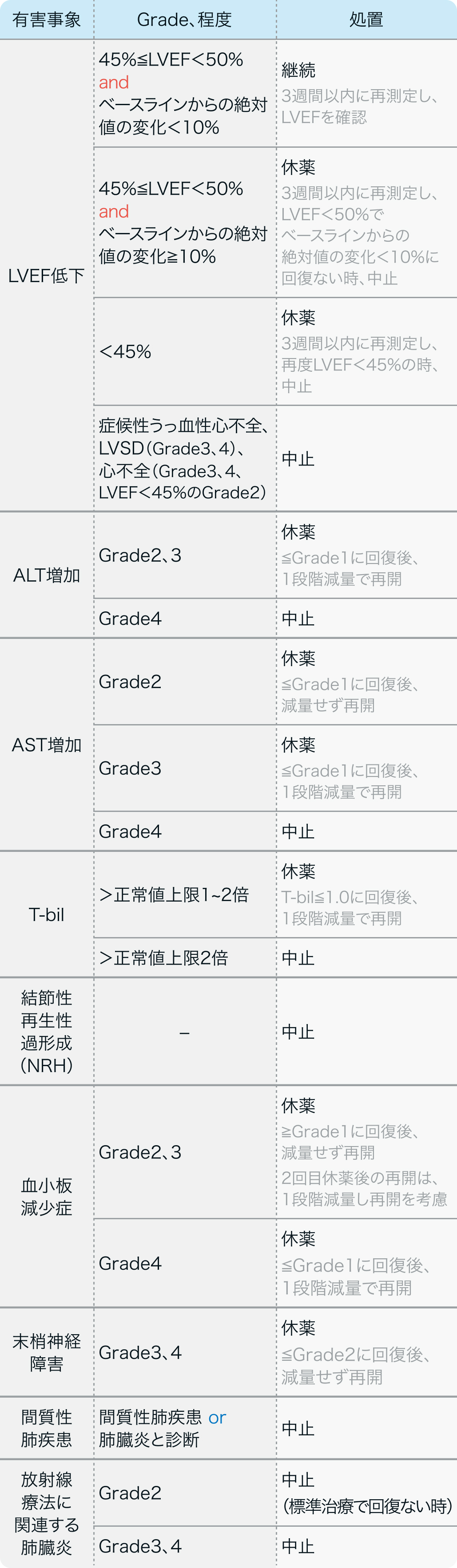
初回基準量と減量レベル

主な有害事象
EMILIA試験¹⁾
有害事象データを一部引用 (カッコ内は≧Grade3)
主な有害事象
- 下痢 23.3% (1.6%)
- 嘔吐 19.0% (0.8%)
- 好中球数減少 5.9% (2.0%)
- 倦怠感 35.1% (2.4%)
- 悪心 39.2% (0.8%)
- 粘膜炎 6.7% (0.2%)
- 貧血 10.4% (2.7%)
- ALT増加 16.9% (2.9%)
- AST増加 22.4% (4.3%)
- 血小板数減少 28.0% (12.9%)
注意すべき有害事象
- 手足症候群 1.2% (0%)
KATHERINE試験²⁾
有害事象データを一部引用
主な有害事象
- 倦怠感 49.5% (1.1%)
- 悪心 41.6% (0.5%)
- 血小板数減少 28.5% (3.6%)
- AST増加 28.4% (0.5%)
- ALT増加 23.1% (0.4%)
- 便秘 17.0% (0.1%)
注意すべき有害事象
- 末梢感覚神経障害 18.6% (1.4%)
特徴と注意点
- HER2陽性の手術不能又は再発乳癌に対して、 2次治療以降で適応となるレジメンである。
- 術前薬物療法で病理学的完全奏効 (pCR) が得られなかったHER2陽性早期乳癌に対する術後薬物療法として、 14サイクルの投与が推奨されるレジメンである。
- 投与開始前に心エコー等により左室駆出率が≥50% (術後は≥55%) であることを確認し、 治療中は定期的に心機能を確認する。
- 初回投与はinfusion reactionに注意しながら90分間で投与を行い、 初回投与の忍容性が良好であれば30分間まで短縮可能である。
- 血小板数及び肝機能検査値は、 特にサイクル1のDay8に治療期間中の最悪値を示す傾向が認められているため、 サイクル1のDay8付近 (Day6-8) で血小板数及び肝機能検査値の測定を行う。
関連する臨床試験①|EMILIA試験¹⁾
トラスツズマブおよびタキサン系薬剤による前治療歴のある、 切除不能で局所進行または転移性のHER2陽性乳癌患者において、 トラスツズマブ エムタンシン (T-DM1) の効果を、 ラパチニブ+カペシタビン併用療法を対照に検証した第Ⅲ相ランダム化比較試験EMILIAの結果より、 無増悪生存期間 (PFS) と全生存期間 (OS) に対する有効性が示された。
IRC評価によるPFS中央値
- T-DM1群:9.6ヵ月
- 対照群:6.4ヵ月
HR 0.65 (95%CI 0.55-0.77)、 p<0.001
OS中央値
- T-DM1群:29.9ヵ月
(95%CI 26.32-34.10ヵ月)
- 対照群:25.9ヵ月
(95%CI 22.74-28.32ヵ月)
HR 0.75 (95%CI 0.64-0.88)
OS率 (1年時、 2年時)
- T-DM1群:85.2%、 64.7%
- 対照群:78.4%、 51.8%
責任医師評価によるPFS中央値
- T-DM1群:9.4ヵ月
- 対照群:5.8ヵ月
HR 0.66 (95%CI 0.56-0.77)、 p<0.001
ORR
- T-DM1群:43.6%
(95%CI 38.6-48.6%)
- 対照群:30.8%
(95%CI 26.3-35.7%)
p<0.001
奏効期間 (中央値)
- T-DM1群:12.6ヵ月
(95%CI 8.4-20.8ヵ月)
- 対照群:6.5ヵ月
(95%CI 5.5-7.2ヵ月)
症状悪化までの期間
FACT-Bスコアが5点以上低下するまでの期間で評価
- T-DM1群:7.1ヵ月
- 対照群:4.6ヵ月
HR 0.80 (95%CI 0.67-0.95)、 p=0.012
関連する臨床試験②|KATHERINE試験²⁾
抗HER2療法を含む術前療法後に浸潤性病変が残存したHER2陽性早期乳癌患者において、 トラスツズマブ エムタンシン (T-DM1) による術後療法の効果を、 トラスツズマブ単独療法を対照に検証した第Ⅲ相ランダム化比較試験KATHERINEの結果より、 浸潤性疾患のない生存期間 (IDFS) に対する有効性が示された。
3年時のIDFS率
- T-DM1群:88.3%
- トラスツズマブ群:77.0%
HR 0.50 (95%CI 0.39-0.64)、 p<0.001
3年時のDFS率
- T-DM1群:76.9%
(95%CI 73.6-80.1%)
- トラスツズマブ群:87.4%
(95%CI 84.9-89.9%)
HR 0.53 (95%CI 0.41-0.68)
OS中央値
未報告
HR 0.70 (95%CI 0.47-1.05)、 p=0.0848
3年時のDRFS率
- T-DM1群:83.0%
(95%CI 80.1–85.9%)
- トラスツズマブ群:89.7%
(95%CI 87.4–92.0%)
HR 0.60 (95%CI 0.45-0.79)
参考文献
- Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012 Nov 8;367(19):1783-91. PMID: 23020162
- Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 Feb 14;380(7):617-628. PMID: 30516102
最終更新日:2023年12月18日
監修医師:HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
T-DM1
トラスツズマブ エムタンシン
2024年03月06日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
用法用量

前投薬
軽度催吐性リスクのため、 デキサメタゾン注を6.6mg前投与する。
投与開始基準
EMILIA試験¹⁾より抜粋
タキサン系薬剤とトラスツズマブによる前治療歴のある切除不能な局所進行性または転移性HER2陽性乳癌の以下に該当する患者
- PS0-1
- 左室駆出率が≧50%以上
減量・休薬・中止基準
HER2陽性の手術不能又は再発乳癌

HER2陽性の乳癌における術後薬物療法

初回基準量と減量レベル

主な有害事象
EMILIA試験¹⁾
有害事象データを一部引用 (カッコ内は≧Grade3)
主な有害事象
- 下痢 23.3% (1.6%)
- 嘔吐 19.0% (0.8%)
- 好中球数減少 5.9% (2.0%)
- 倦怠感 35.1% (2.4%)
- 悪心 39.2% (0.8%)
- 粘膜炎 6.7% (0.2%)
- 貧血 10.4% (2.7%)
- ALT増加 16.9% (2.9%)
- AST増加 22.4% (4.3%)
- 血小板数減少 28.0% (12.9%)
注意すべき有害事象
- 手足症候群 1.2% (0%)
KATHERINE試験²⁾
有害事象データを一部引用
主な有害事象
- 倦怠感 49.5% (1.1%)
- 悪心 41.6% (0.5%)
- 血小板数減少 28.5% (3.6%)
- AST増加 28.4% (0.5%)
- ALT増加 23.1% (0.4%)
- 便秘 17.0% (0.1%)
注意すべき有害事象
- 末梢感覚神経障害 18.6% (1.4%)
特徴と注意点
- HER2陽性の手術不能又は再発乳癌に対して、 2次治療以降で適応となるレジメンである。
- 術前薬物療法で病理学的完全奏効 (pCR) が得られなかったHER2陽性早期乳癌に対する術後薬物療法として、 14サイクルの投与が推奨されるレジメンである。
- 投与開始前に心エコー等により左室駆出率が≥50% (術後は≥55%) であることを確認し、 治療中は定期的に心機能を確認する。
- 初回投与はinfusion reactionに注意しながら90分間で投与を行い、 初回投与の忍容性が良好であれば30分間まで短縮可能である。
- 血小板数及び肝機能検査値は、 特にサイクル1のDay8に治療期間中の最悪値を示す傾向が認められているため、 サイクル1のDay8付近 (Day6-8) で血小板数及び肝機能検査値の測定を行う。
関連する臨床試験①|EMILIA試験¹⁾
トラスツズマブおよびタキサン系薬剤による前治療歴のある、 切除不能で局所進行または転移性のHER2陽性乳癌患者において、 トラスツズマブ エムタンシン (T-DM1) の効果を、 ラパチニブ+カペシタビン併用療法を対照に検証した第Ⅲ相ランダム化比較試験EMILIAの結果より、 無増悪生存期間 (PFS) と全生存期間 (OS) に対する有効性が示された。
IRC評価によるPFS中央値
- T-DM1群:9.6ヵ月
- 対照群:6.4ヵ月
HR 0.65 (95%CI 0.55-0.77)、 p<0.001
OS中央値
- T-DM1群:29.9ヵ月
(95%CI 26.32-34.10ヵ月)
- 対照群:25.9ヵ月
(95%CI 22.74-28.32ヵ月)
HR 0.75 (95%CI 0.64-0.88)
OS率 (1年時、 2年時)
- T-DM1群:85.2%、 64.7%
- 対照群:78.4%、 51.8%
責任医師評価によるPFS中央値
- T-DM1群:9.4ヵ月
- 対照群:5.8ヵ月
HR 0.66 (95%CI 0.56-0.77)、 p<0.001
ORR
- T-DM1群:43.6%
(95%CI 38.6-48.6%)
- 対照群:30.8%
(95%CI 26.3-35.7%)
p<0.001
奏効期間 (中央値)
- T-DM1群:12.6ヵ月
(95%CI 8.4-20.8ヵ月)
- 対照群:6.5ヵ月
(95%CI 5.5-7.2ヵ月)
症状悪化までの期間
FACT-Bスコアが5点以上低下するまでの期間で評価
- T-DM1群:7.1ヵ月
- 対照群:4.6ヵ月
HR 0.80 (95%CI 0.67-0.95)、 p=0.012
関連する臨床試験②|KATHERINE試験²⁾
抗HER2療法を含む術前療法後に浸潤性病変が残存したHER2陽性早期乳癌患者において、 トラスツズマブ エムタンシン (T-DM1) による術後療法の効果を、 トラスツズマブ単独療法を対照に検証した第Ⅲ相ランダム化比較試験KATHERINEの結果より、 浸潤性疾患のない生存期間 (IDFS) に対する有効性が示された。
3年時のIDFS率
- T-DM1群:88.3%
- トラスツズマブ群:77.0%
HR 0.50 (95%CI 0.39-0.64)、 p<0.001
3年時のDFS率
- T-DM1群:76.9%
(95%CI 73.6-80.1%)
- トラスツズマブ群:87.4%
(95%CI 84.9-89.9%)
HR 0.53 (95%CI 0.41-0.68)
OS中央値
未報告
HR 0.70 (95%CI 0.47-1.05)、 p=0.0848
3年時のDRFS率
- T-DM1群:83.0%
(95%CI 80.1–85.9%)
- トラスツズマブ群:89.7%
(95%CI 87.4–92.0%)
HR 0.60 (95%CI 0.45-0.79)
参考文献
- Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012 Nov 8;367(19):1783-91. PMID: 23020162
- Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 Feb 14;380(7):617-628. PMID: 30516102
最終更新日:2023年12月18日
監修医師:HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(乳腺)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。