Abemaciclib + ホルモン療法
アベマシクリブ (ベージニオ®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
用法用量
適応疾患
ホルモン受容体陽性かつHER2陰性乳がんにおいて、 手術不能又は再発乳がん、または再発高リスク例に対する術後補助化学療法として使用
投与スケジュール
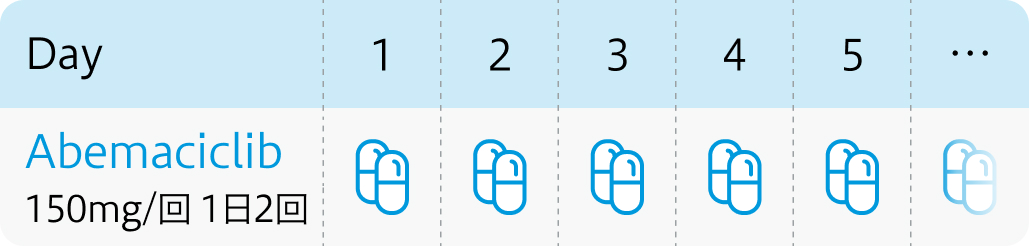
・ 手術不能又は再発乳がん : 病勢増悪まで継続
・ 術後薬物療法 : 投与期間24ヵ月間*まで継続
*monarchE試験²⁾の設定を踏まえたもの
①フルベストラントとの併用
本剤150mgを12時間ごとに経口投与し、 フルベストラントは500mgを1日目、 15日目及び29日目並びにその後は4週毎に筋肉内投与
MONARCH 2試験の設定を踏まえたもの
②レトロゾール又はアナストロゾールとの併用
本剤150mgを12時間ごとに経口投与し、 レトロゾールは2.5mg またはアナストロゾールは1mgを1日1回経口投与
MONARCH 3試験の設定を踏まえたもの
③標準的な内分泌療法剤との併用
本剤150mgを1日2回経口投与し、 標準的な内分泌療法剤* を最低5年間最長10年間投与
monarchE試験の設定を踏まえたもの *タモキシフェン、 アロマターゼ阻害剤等の単独投与、 又はLH-RHアゴニストとの併用
投与開始基準
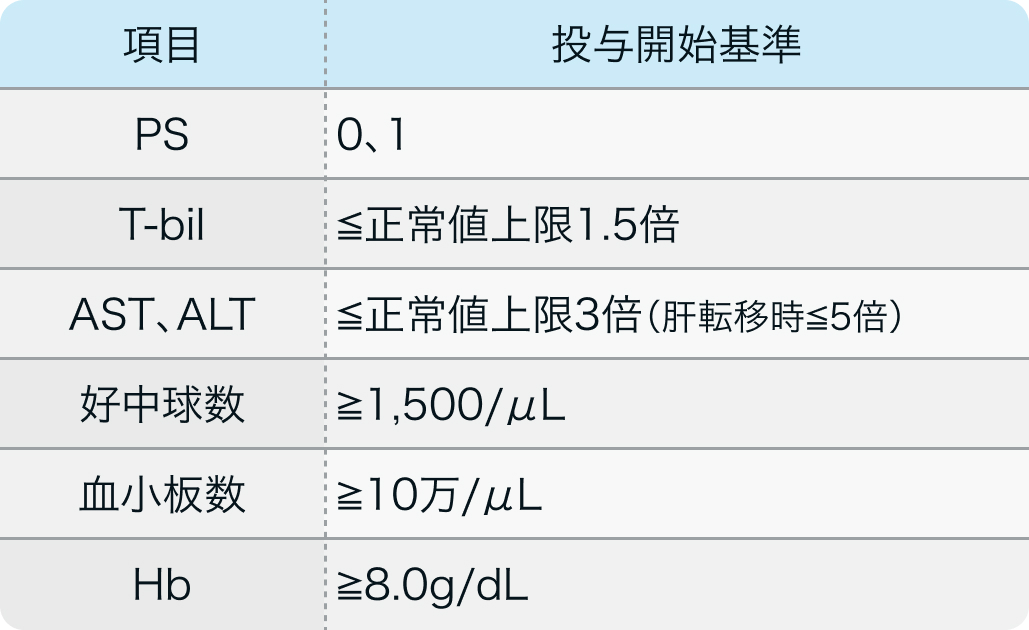
初期治療
MONARCH3試験より抜粋¹⁾
18歳以上で治癒目的の外科的切除または放射線療法が適応とならない局所検査でHR陽性、 HER2陰性の局所再発乳癌、 または転移性乳癌のPS1以下の閉経後女性
術後療法
monarchE試験より抜粋²⁾
女性 (閉経状態に関係なく) または18歳以上の男性で、 HR陽性、 HER2陰性の遠隔転移を認めない早期切除浸潤性乳癌の下記のいずれかに該当する患者
- 腋窩リンパ節転移4個以上
- 腫瘍径5cm以上、 組織学的Grade3のいずれかを満たし腋窩リンパ節転移1~3個
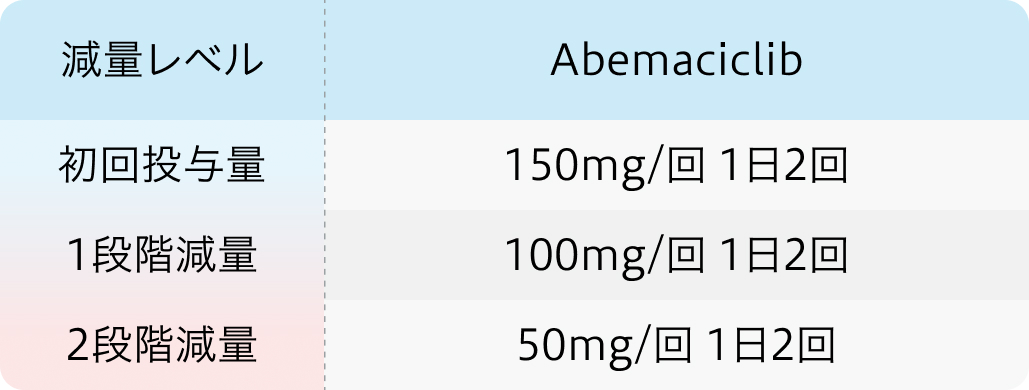
減量・休薬・中止基準

初回基準量と減量レベル
主な有害事象
MONARCH 3試験¹⁾³⁾
日本人サブグループ38例の有害事象データを一部引用 (カッコ内はGrade3~4)³⁾
主な有害事象
- 下痢 94.7% (10.5%)
- 好中球減少症 68.4% (21.1%)
- 白血球減少症 55.3% (21.1%)
- ALT増加 50.0% (26.3%)
- 貧血 50.0% (10.5%)
- AST増加 50.0% (15.8%)
- 悪心 36.8% (0%)
- 嘔吐 28.9% (0%)
- 食欲低下 23.7% (2.6%)
- 倦怠感 13.2% (0%)
注意すべき有害事象
- 脱毛症 39.5% (0%)
特徴と注意点
- アベマシクリブは1日2回を連日服用。 食前・食後による薬物動態変化は受けない。
- 下痢が最も頻度が高い副作用であり、 全Grade 80%以上と好発する¹⁾。 下痢を認めた場合は水分補給を行い、 止瀉薬としてロペラミド等を服用することを予め患者に指導しておく。
- アベマシクリブの投与後1か月以内に、 血清Cre値が見かけ上1.15~1.40倍程度上昇する。 これは血清Creの尿細管分泌阻害作用によるものである。
- 好中球減少症が認められることがあるため、 感染症対策および発熱時の対応を患者に指導する。
- 間質性肺炎により死亡例も報告されているため、 息切れ、 咳症状などに注意し、 定期的な画像評価を行う。
- 脱毛は約10~30%の頻度で出現し、 臨床試験ではGrade1 (遠くからではわからない程度) が8~25%、 Grade2 (50%以上の脱毛)が1~2%で認められた¹⁻³⁾。
関連する臨床試験①|MONARCH3試験¹⁾
無増悪生存期間 (PFS)の中央値は、 プラセボ群の14.7ヵ月に対し、 アベマシクリブ群では未到達だった(HR 0.54、 95%CI 0.41-0.72、 P = 0.000021)。 アベマシクリブ群で最も多く認められた副作用は、 下痢 (81.3%) だったが、 うちGrade1 が44.6%を占めた。 主なGrade3/4の有害事象は、 好中球減少症 (アベマシクリブ群21.1% vs プラセボ群1.2%)、 下痢 (9.5% vs 1.2%)、 および白血球減少症 (7.6% vs 0.6%)だった。
PFS中央値
- アベマシクリブ群 : 28.18ヵ月
- プラセボ群 : 14.76ヵ月
HR 0.540 (95%CI 0.418-0.698)、 p=0.000002
ORR
- アベマシクリブ群 : 61.0%
(95%CI 55.2-66.9%)
- プラセボ群 : 45.5%
(95%CI 37.0-53.9%)
p=0.003
DOR中央値
- アベマシクリブ群 : 27.39ヵ月
- プラセボ群 : 17.46ヵ月
関連する臨床試験②|monarchE試験²⁾
ER陽性HER2陰性の再発ハイリスク早期乳癌患者において、 アベマシクリブ+内分泌療法 (ET) 併用療法の効果を、 ET群を対照に検証した第Ⅲ相無作為化比較試験monarchEの結果より、 浸潤性疾患のない生存期間 (IDFS) における有意な改善が示された。
IDFS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群336例 (12.0%)、 ET群499例 (17.6%)
HR 0.664 (95%CI 0.578-0.762)、 p<0.0001
IDFS率 (2年時、 3年時、 4年時)
- アベマシクリブ+ET群 : 92.7%、 89.2%、 85.8%
- ET群 : 89.9%、 84.4%、 79.4%
DRFS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群281例 (10.0%)、 ET群421例 (14.9%)
HR 0.659 (95%CI 0.567-0.767)、 p<0.0001
DRFS率 (2年時、 3年時、 4年時)
- アベマシクリブ+ET群 : 94.0%、 90.8%、 88.4%
- ET群 : 91.6%、 86.8%、 82.5%
OS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群157例 (5.6%)、 ET群173例 (6.1%)
HR 0.929 (95%CI 0.748-1.153)、 p=0.50
関連する臨床試験③|MONARCH2試験
ホルモン療法中に進行したホルモン受容体陽性HER2陰性の局所進行性または転移性乳癌患者において、 CDK4/6阻害薬アベマシクリブ+フルベストラントの効果を、 プラセボ+フルベストラントを対照に検証した第Ⅲ相無作為化二重盲検試験MONARCH 2の結果より、 無増悪生存期間 (PFS) と奏効率 (ORR) における有意な改善が示された。
PFS中央値
- アベマシクリブ群 : 16.9ヵ月
- プラセボ群 : 9.3ヵ月
HR 0.536 (95%CI 0.445-0.645)、 p<0.001
PFS率 (3年時)
- アベマシクリブ群 : 29.9%
- プラセボ群 : 10.1%
ORR
- アベマシクリブ群 : 35.2%
(95%CI 30.8-39.6%)
- プラセボ群 : 16.1%
(95%CI 11.3-21.0%)
オッズ比2.82、 p<0.001
12ヵ月奏効を持続した割合
- アベマシクリブ群 : 67.8%
- プラセボ群 : 66.9%
OS中央値
- アベマシクリブ群 : 46.7ヵ月
- プラセボ群 : 37.3ヵ月
HR 0.757 (95%CI 0.606-0.945)、 p=0.01
CBR
- アベマシクリブ群 : 72.2%
(95%CI 68.0-76.4%)
- プラセボ群 : 56.1%
(95%CI 49.5-62.6%)
p<0.001
TTC中央値
- アベマシクリブ群 : 50.2ヵ月
- プラセボ群 : 22.1ヵ月
HR 0.625 (95%CI 0.501-0.779)、 p<0.001
参考文献
- MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol. 2017 Nov 10;35(32):3638-3646. PMID: 28968163
- Abemaciclib Combined With Endocrine Therapy for the Adjuvant Treatment of HR+, HER2-, Node-Positive, High-Risk, Early Breast Cancer (monarchE). J Clin Oncol. 2020 Dec 1;38(34):3987-3998. PMID: 32954927
- Japanese subgroup analysis of the phase 3 MONARCH 3 study of abemaciclib as initial therapy for patients with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer. Breast Cancer. 2022 Jan;29(1):174-184. PMID: 34661821
- MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol. 2017 Sep 1;35(25):2875-2884.PMID: 28580882
最終更新日 : 2023年11月8日
監修医師 : HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
Abemaciclib + ホルモン療法
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
用法用量
適応疾患
ホルモン受容体陽性かつHER2陰性乳がんにおいて、 手術不能又は再発乳がん、または再発高リスク例に対する術後補助化学療法として使用
投与スケジュール

・ 手術不能又は再発乳がん : 病勢増悪まで継続
・ 術後薬物療法 : 投与期間24ヵ月間*まで継続
*monarchE試験²⁾の設定を踏まえたもの
①フルベストラントとの併用
本剤150mgを12時間ごとに経口投与し、 フルベストラントは500mgを1日目、 15日目及び29日目並びにその後は4週毎に筋肉内投与
MONARCH 2試験の設定を踏まえたもの
②レトロゾール又はアナストロゾールとの併用
本剤150mgを12時間ごとに経口投与し、 レトロゾールは2.5mg またはアナストロゾールは1mgを1日1回経口投与
MONARCH 3試験の設定を踏まえたもの
③標準的な内分泌療法剤との併用
本剤150mgを1日2回経口投与し、 標準的な内分泌療法剤* を最低5年間最長10年間投与
monarchE試験の設定を踏まえたもの *タモキシフェン、 アロマターゼ阻害剤等の単独投与、 又はLH-RHアゴニストとの併用
投与開始基準

初期治療
MONARCH3試験より抜粋¹⁾
18歳以上で治癒目的の外科的切除または放射線療法が適応とならない局所検査でHR陽性、 HER2陰性の局所再発乳癌、 または転移性乳癌のPS1以下の閉経後女性
術後療法
monarchE試験より抜粋²⁾
女性 (閉経状態に関係なく) または18歳以上の男性で、 HR陽性、 HER2陰性の遠隔転移を認めない早期切除浸潤性乳癌の下記のいずれかに該当する患者
- 腋窩リンパ節転移4個以上
- 腫瘍径5cm以上、 組織学的Grade3のいずれかを満たし腋窩リンパ節転移1~3個
減量・休薬・中止基準

初回基準量と減量レベル

主な有害事象
MONARCH 3試験¹⁾³⁾
日本人サブグループ38例の有害事象データを一部引用 (カッコ内はGrade3~4)³⁾
主な有害事象
- 下痢 94.7% (10.5%)
- 好中球減少症 68.4% (21.1%)
- 白血球減少症 55.3% (21.1%)
- ALT増加 50.0% (26.3%)
- 貧血 50.0% (10.5%)
- AST増加 50.0% (15.8%)
- 悪心 36.8% (0%)
- 嘔吐 28.9% (0%)
- 食欲低下 23.7% (2.6%)
- 倦怠感 13.2% (0%)
注意すべき有害事象
- 脱毛症 39.5% (0%)
特徴と注意点
- アベマシクリブは1日2回を連日服用。 食前・食後による薬物動態変化は受けない。
- 下痢が最も頻度が高い副作用であり、 全Grade 80%以上と好発する¹⁾。 下痢を認めた場合は水分補給を行い、 止瀉薬としてロペラミド等を服用することを予め患者に指導しておく。
- アベマシクリブの投与後1か月以内に、 血清Cre値が見かけ上1.15~1.40倍程度上昇する。 これは血清Creの尿細管分泌阻害作用によるものである。
- 好中球減少症が認められることがあるため、 感染症対策および発熱時の対応を患者に指導する。
- 間質性肺炎により死亡例も報告されているため、 息切れ、 咳症状などに注意し、 定期的な画像評価を行う。
- 脱毛は約10~30%の頻度で出現し、 臨床試験ではGrade1 (遠くからではわからない程度) が8~25%、 Grade2 (50%以上の脱毛)が1~2%で認められた¹⁻³⁾。
関連する臨床試験①|MONARCH3試験¹⁾
無増悪生存期間 (PFS)の中央値は、 プラセボ群の14.7ヵ月に対し、 アベマシクリブ群では未到達だった(HR 0.54、 95%CI 0.41-0.72、 P = 0.000021)。 アベマシクリブ群で最も多く認められた副作用は、 下痢 (81.3%) だったが、 うちGrade1 が44.6%を占めた。 主なGrade3/4の有害事象は、 好中球減少症 (アベマシクリブ群21.1% vs プラセボ群1.2%)、 下痢 (9.5% vs 1.2%)、 および白血球減少症 (7.6% vs 0.6%)だった。
PFS中央値
- アベマシクリブ群 : 28.18ヵ月
- プラセボ群 : 14.76ヵ月
HR 0.540 (95%CI 0.418-0.698)、 p=0.000002
ORR
- アベマシクリブ群 : 61.0%
(95%CI 55.2-66.9%)
- プラセボ群 : 45.5%
(95%CI 37.0-53.9%)
p=0.003
DOR中央値
- アベマシクリブ群 : 27.39ヵ月
- プラセボ群 : 17.46ヵ月
関連する臨床試験②|monarchE試験²⁾
ER陽性HER2陰性の再発ハイリスク早期乳癌患者において、 アベマシクリブ+内分泌療法 (ET) 併用療法の効果を、 ET群を対照に検証した第Ⅲ相無作為化比較試験monarchEの結果より、 浸潤性疾患のない生存期間 (IDFS) における有意な改善が示された。
IDFS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群336例 (12.0%)、 ET群499例 (17.6%)
HR 0.664 (95%CI 0.578-0.762)、 p<0.0001
IDFS率 (2年時、 3年時、 4年時)
- アベマシクリブ+ET群 : 92.7%、 89.2%、 85.8%
- ET群 : 89.9%、 84.4%、 79.4%
DRFS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群281例 (10.0%)、 ET群421例 (14.9%)
HR 0.659 (95%CI 0.567-0.767)、 p<0.0001
DRFS率 (2年時、 3年時、 4年時)
- アベマシクリブ+ET群 : 94.0%、 90.8%、 88.4%
- ET群 : 91.6%、 86.8%、 82.5%
OS
- 中央値は両群とも到達せず
- イベント数はアベマシクリブ+ET群157例 (5.6%)、 ET群173例 (6.1%)
HR 0.929 (95%CI 0.748-1.153)、 p=0.50
関連する臨床試験③|MONARCH2試験
ホルモン療法中に進行したホルモン受容体陽性HER2陰性の局所進行性または転移性乳癌患者において、 CDK4/6阻害薬アベマシクリブ+フルベストラントの効果を、 プラセボ+フルベストラントを対照に検証した第Ⅲ相無作為化二重盲検試験MONARCH 2の結果より、 無増悪生存期間 (PFS) と奏効率 (ORR) における有意な改善が示された。
PFS中央値
- アベマシクリブ群 : 16.9ヵ月
- プラセボ群 : 9.3ヵ月
HR 0.536 (95%CI 0.445-0.645)、 p<0.001
PFS率 (3年時)
- アベマシクリブ群 : 29.9%
- プラセボ群 : 10.1%
ORR
- アベマシクリブ群 : 35.2%
(95%CI 30.8-39.6%)
- プラセボ群 : 16.1%
(95%CI 11.3-21.0%)
オッズ比2.82、 p<0.001
12ヵ月奏効を持続した割合
- アベマシクリブ群 : 67.8%
- プラセボ群 : 66.9%
OS中央値
- アベマシクリブ群 : 46.7ヵ月
- プラセボ群 : 37.3ヵ月
HR 0.757 (95%CI 0.606-0.945)、 p=0.01
CBR
- アベマシクリブ群 : 72.2%
(95%CI 68.0-76.4%)
- プラセボ群 : 56.1%
(95%CI 49.5-62.6%)
p<0.001
TTC中央値
- アベマシクリブ群 : 50.2ヵ月
- プラセボ群 : 22.1ヵ月
HR 0.625 (95%CI 0.501-0.779)、 p<0.001
参考文献
- MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol. 2017 Nov 10;35(32):3638-3646. PMID: 28968163
- Abemaciclib Combined With Endocrine Therapy for the Adjuvant Treatment of HR+, HER2-, Node-Positive, High-Risk, Early Breast Cancer (monarchE). J Clin Oncol. 2020 Dec 1;38(34):3987-3998. PMID: 32954927
- Japanese subgroup analysis of the phase 3 MONARCH 3 study of abemaciclib as initial therapy for patients with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer. Breast Cancer. 2022 Jan;29(1):174-184. PMID: 34661821
- MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol. 2017 Sep 1;35(25):2875-2884.PMID: 28580882
最終更新日 : 2023年11月8日
監修医師 : HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。