Tazemetostat
タゼメトスタット(タズベリク®)再発難治例
治療スケジュール
概要
監修医師
Tazemetostat:タゼメトスタット(タズベリク®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg 1日2回 経口 | 1~ | Day 1~ |
その他
| 少なくとも2つ以上の標準的な治療が無効となったEZH2遺伝子変異陽性の濾胞性リンパ腫患者が適応. |
| 有害事象発現時の減量・休薬・中止基準は概要を参照. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「エーザイ株式会社」 の外部サイトへ遷移します.
主な有害事象
骨髄抑制
国内206試験¹⁾
- 好中球減少 (≧Grade3 5.9%)
- リンパ球減少 (≧Grade3 11.8%)
海外101試験²⁾
- 好中球減少 (≧Grade3 2.2%)
- 血小板減少 (≧Grade3 4.4%)
主な有害事象
国内206試験¹⁾
- 味覚異常 (52.9%、 ≧Grade3 0%)
- 口内炎 (11.8%、 ≧Grade3 0%)
- 便秘 (11.8%、 ≧Grade3 0%)
- 悪心 (11.8%、 ≧Grade3 0%)
- 上気道炎 (11.8%、 ≧Grade3 0%)
- 脱毛 (11.8%、 ≧Grade3 0%)
- 湿疹 (11.8%、 ≧Grade3 0%)
- 倦怠感 (11.8%、 ≧Grade3 0%)
- アミラーゼ増加 (11.8%、 ≧Grade3 0%)
- 体重減少 (11.8%、 ≧Grade3 0%)
- 血中クレアチニン増加 (11.8%、 ≧Grade3 0%)
- ALT上昇 (11.8%、 ≧Grade3 0%)
- AST上昇 (11.8%、 ≧Grade3 0%)
海外101試験²⁾
- 味覚異常 (11.1%、 ≧Grade3 0%)
- 悪心 (17.8%、 ≧Grade3 0%)
- 下痢 (13.3%、 ≧Grade3 0%)
- 脱毛 (22.2%、 ≧Grade3 0%)
- 無力症 (15.6%、 ≧Grade3 0%)
- 疲労 (13.3%、 ≧Grade3 0%)
重要な有害事象
- 光線過敏症 (頻度不明)
- 二次性悪性腫瘍 (頻度不明)
特徴と注意点
適応
- 再発又は難治性のEZH2遺伝子変異陽性の濾胞性リンパ腫に保険適用.
- Tazemetostatの使用は、 濾胞性リンパ腫に対する少なくとも2つ以上の標準的な治療が無効となった場合に限る.
- コンパニオン診断薬である「コバス®EZH2変異検出キット」により、 EZH2遺伝子変異陽性が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」³⁾ を参照する.
- 具体的には、 がん組織 (ホルマリン固定パラフィン包埋組織) から抽出したゲノムDNA中のEZH2遺伝子変異をロシュ・ダイアグノスティックス株式会社の遺伝子解析装置「コバスz480」を用いてリアルタイムPCR法により検出を行う.
副作用と対策
- 日本人に特徴的な有害事象として味覚異常、 リンパ球減少症、 口内炎が挙げられている.
- 中等度以上の肝機能障害のある患者では血中濃度が上昇するおそれがあるため、 注意する.
- 海外101試験において光線過敏症が報告されているため、 日光への長期暴露を避けるよう指導する.
- 肺炎、 ニューモシスチス・イロベチイ肺炎、 異型肺炎などの感染症に注意する.
- 骨髄異形成症候群、 急性骨髄性白血病などの二次性悪性腫瘍が報告されている.
- CYP2C8の阻害作用を有する.
- CYP3A4で代謝され、 誘導作用を有する.
減量・中止基準
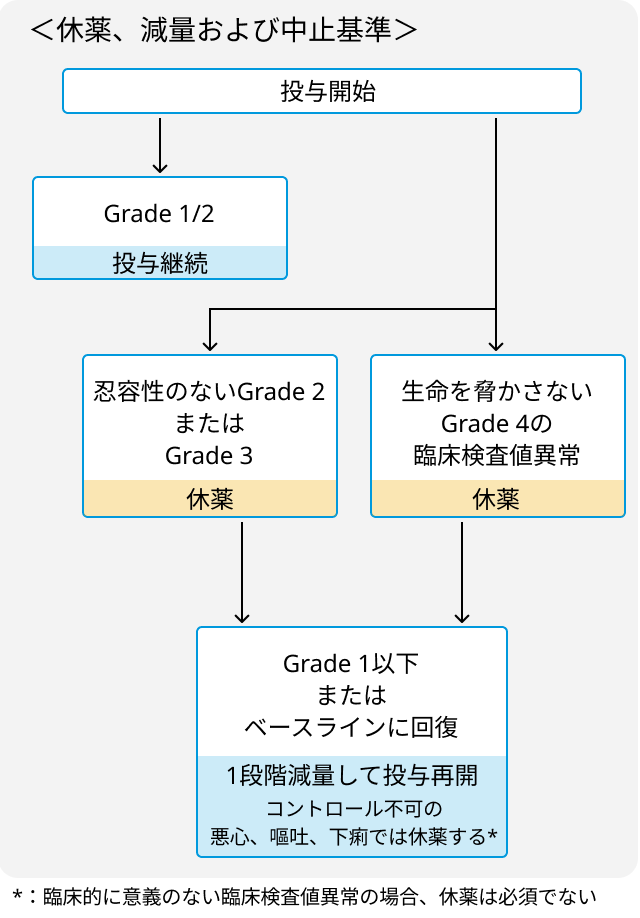
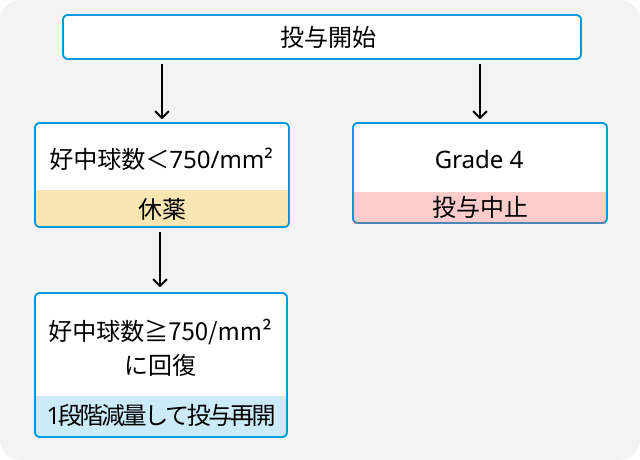
関連する臨床試験の結果
国内206試験¹⁾
概要
- 対象:再発または難治性のEZH2遺伝子変異陽性濾胞性リンパ腫
- 日本人への有効性を評価する第2相試験
- 主要評価項目:奏効率
結果
- 奏効率:76.5%
海外101試験²⁾
概要
- 対象:再発または難治性のEZH2遺伝子変異陽性濾胞性リンパ腫
- 有効性を評価する第2相試験
- 主要評価項目:奏効率
結果
- 奏効率:68.9%
参考文献
- Cancer Sci. 2021 Sep;112(9):3627-3635.
- Lancet Oncol. 2020 Nov;21(11):1433-1442.
- 医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報
最終更新:2022年8月29日
執筆担当:北海道がんセンタ-薬剤部 深井雄太
監修医師:東海大学血液腫瘍内科 扇屋大輔
Tazemetostat
タゼメトスタット(タズベリク®)再発難治例
2023年06月04日更新
Tazemetostat:タゼメトスタット(タズベリク®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg 1日2回 経口 | 1~ | Day 1~ |
その他
| 少なくとも2つ以上の標準的な治療が無効となったEZH2遺伝子変異陽性の濾胞性リンパ腫患者が適応. |
| 有害事象発現時の減量・休薬・中止基準は概要を参照. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「エーザイ株式会社」 の外部サイトへ遷移します.
主な有害事象
骨髄抑制
国内206試験¹⁾
- 好中球減少 (≧Grade3 5.9%)
- リンパ球減少 (≧Grade3 11.8%)
海外101試験²⁾
- 好中球減少 (≧Grade3 2.2%)
- 血小板減少 (≧Grade3 4.4%)
主な有害事象
国内206試験¹⁾
- 味覚異常 (52.9%、 ≧Grade3 0%)
- 口内炎 (11.8%、 ≧Grade3 0%)
- 便秘 (11.8%、 ≧Grade3 0%)
- 悪心 (11.8%、 ≧Grade3 0%)
- 上気道炎 (11.8%、 ≧Grade3 0%)
- 脱毛 (11.8%、 ≧Grade3 0%)
- 湿疹 (11.8%、 ≧Grade3 0%)
- 倦怠感 (11.8%、 ≧Grade3 0%)
- アミラーゼ増加 (11.8%、 ≧Grade3 0%)
- 体重減少 (11.8%、 ≧Grade3 0%)
- 血中クレアチニン増加 (11.8%、 ≧Grade3 0%)
- ALT上昇 (11.8%、 ≧Grade3 0%)
- AST上昇 (11.8%、 ≧Grade3 0%)
海外101試験²⁾
- 味覚異常 (11.1%、 ≧Grade3 0%)
- 悪心 (17.8%、 ≧Grade3 0%)
- 下痢 (13.3%、 ≧Grade3 0%)
- 脱毛 (22.2%、 ≧Grade3 0%)
- 無力症 (15.6%、 ≧Grade3 0%)
- 疲労 (13.3%、 ≧Grade3 0%)
重要な有害事象
- 光線過敏症 (頻度不明)
- 二次性悪性腫瘍 (頻度不明)
特徴と注意点
適応
- 再発又は難治性のEZH2遺伝子変異陽性の濾胞性リンパ腫に保険適用.
- Tazemetostatの使用は、 濾胞性リンパ腫に対する少なくとも2つ以上の標準的な治療が無効となった場合に限る.
- コンパニオン診断薬である「コバス®EZH2変異検出キット」により、 EZH2遺伝子変異陽性が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」³⁾ を参照する.
- 具体的には、 がん組織 (ホルマリン固定パラフィン包埋組織) から抽出したゲノムDNA中のEZH2遺伝子変異をロシュ・ダイアグノスティックス株式会社の遺伝子解析装置「コバスz480」を用いてリアルタイムPCR法により検出を行う.
副作用と対策
- 日本人に特徴的な有害事象として味覚異常、 リンパ球減少症、 口内炎が挙げられている.
- 中等度以上の肝機能障害のある患者では血中濃度が上昇するおそれがあるため、 注意する.
- 海外101試験において光線過敏症が報告されているため、 日光への長期暴露を避けるよう指導する.
- 肺炎、 ニューモシスチス・イロベチイ肺炎、 異型肺炎などの感染症に注意する.
- 骨髄異形成症候群、 急性骨髄性白血病などの二次性悪性腫瘍が報告されている.
- CYP2C8の阻害作用を有する.
- CYP3A4で代謝され、 誘導作用を有する.
減量・中止基準


関連する臨床試験の結果
国内206試験¹⁾
概要
- 対象:再発または難治性のEZH2遺伝子変異陽性濾胞性リンパ腫
- 日本人への有効性を評価する第2相試験
- 主要評価項目:奏効率
結果
- 奏効率:76.5%
海外101試験²⁾
概要
- 対象:再発または難治性のEZH2遺伝子変異陽性濾胞性リンパ腫
- 有効性を評価する第2相試験
- 主要評価項目:奏効率
結果
- 奏効率:68.9%
参考文献
- Cancer Sci. 2021 Sep;112(9):3627-3635.
- Lancet Oncol. 2020 Nov;21(11):1433-1442.
- 医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報
最終更新:2022年8月29日
執筆担当:北海道がんセンタ-薬剤部 深井雄太
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。