Pembrolizumab+nab-Paclitaxel (3週投与1週休薬)
ペムブロリズマブ+アルブミン懸濁型 (nab) パクリタキセル
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
*大鵬薬品の外部サイトへ遷移します
用法用量
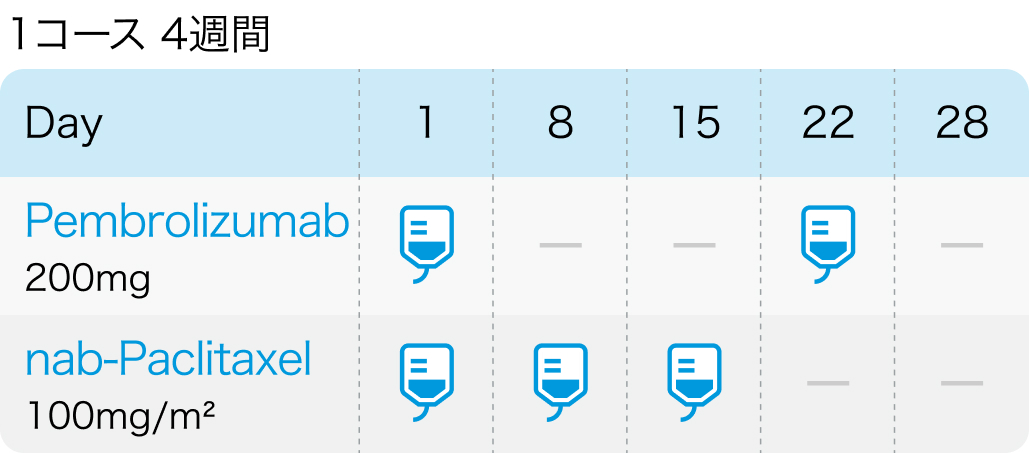
Pembrolizumabは3週ごと、nab-PaclitaxelはD1,8,15に4週ごと投与
前投薬
アルブミン懸濁型パクリタキセルであるnab-PTXは従来のパクリタキセルに含まれる添加物であるポリオキシエチレンヒマシ油を含まないため、 抗ヒスタミン薬などの前投薬は不要。 またアルコールも含有しないため、 アルコール不耐の患者にも使用可能。
投与開始基準
KEYNOTE-355試験¹⁾より抜粋
化学療法歴がなく治癒・手術不能な、 局所再発のPD-L1陽性または転移性乳癌のPS0、 1かつ18歳以上の患者
休薬・中止・減量基準
ペムブロリズマブの休薬・中止・減量基準

初回基準量と減量レベル

主な有害事象
KEYNOTE-355試験¹
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 貧血 48.8% (16.4%)
- 好中球減少症 40.4% (29.2%)
- 悪心 38.4% (1.5%)
- 疲労 27.5% (2.9%)
- 好中球減少 22.1% (17.3%)
- ALT増加 19.8% (5.7%)
- 下痢 19.3% (1.3%)
- 血小板数減少症 19.1% (9.9%)
- 白血球数減少症 19.0% (9.7%)
- AST増加 18.6% (4.4%)
- 嘔吐 18.6% (2.2%)
- 白血球減少 18.1% (10.2%)
- 食欲減退 16.3% (0.8%)
- 血小板数減少 15.1% (6.0%)
- 便秘 13.4% (0.5%)
- 甲状腺機能低下症 13.4% (0.3%)
- 発熱 9.7% (0.5%)
- 口内炎 7.9% (0.3%)
- 体重減少 5.7% (0.3%)
- リンパ球数減少 5.0% (2.3%)
注意すべき有害事象
- 脱毛症 33.1% (0.8%)
- 末梢性ニューロパチー 10.2% (1.0%)
- 末梢性感覚ニューロパチー 9.2% (1.3%)
特徴と注意点
- PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌にたいして使用。
- PD-L1検査でCPS≧10にて有効性が確認されている。
- 免疫チェックポイント阻害薬の有害事象は多岐にわたり、 発現時期も明確でないため、 患者の体調変化を注意深く観察する必要がある。
- ペムブロリズマブ投与時は、 インラインフィルター (0.2~5μm) を使用する。
- nab-PTXは人血清アルブミンを用いており、 特定生物由来製品に該当する。 投与した場合は、 医薬品名 (販売名) 、 製造番号又は製造記号 (ロット番号) 、 使用年月日、使用した患者の氏名、 住所等を記載し少なくとも20年間の保管が必要となる。
- nab-PTXの投与にあたっては、 ヒト血液を原料としていることに由来する感染症伝播のリスクを完全に排除できないことなど、 リスクについても十分に患者に対して説明し、 理解を得る必要がある。
参考文献
最終更新日:2023年10月18日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
Pembrolizumab+nab-Paclitaxel (3週投与1週休薬)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
*大鵬薬品の外部サイトへ遷移します
用法用量

Pembrolizumabは3週ごと、nab-PaclitaxelはD1,8,15に4週ごと投与
前投薬
アルブミン懸濁型パクリタキセルであるnab-PTXは従来のパクリタキセルに含まれる添加物であるポリオキシエチレンヒマシ油を含まないため、 抗ヒスタミン薬などの前投薬は不要。 またアルコールも含有しないため、 アルコール不耐の患者にも使用可能。
投与開始基準
KEYNOTE-355試験¹⁾より抜粋
化学療法歴がなく治癒・手術不能な、 局所再発のPD-L1陽性または転移性乳癌のPS0、 1かつ18歳以上の患者
休薬・中止・減量基準
ペムブロリズマブの休薬・中止・減量基準

初回基準量と減量レベル

主な有害事象
KEYNOTE-355試験¹
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 貧血 48.8% (16.4%)
- 好中球減少症 40.4% (29.2%)
- 悪心 38.4% (1.5%)
- 疲労 27.5% (2.9%)
- 好中球減少 22.1% (17.3%)
- ALT増加 19.8% (5.7%)
- 下痢 19.3% (1.3%)
- 血小板数減少症 19.1% (9.9%)
- 白血球数減少症 19.0% (9.7%)
- AST増加 18.6% (4.4%)
- 嘔吐 18.6% (2.2%)
- 白血球減少 18.1% (10.2%)
- 食欲減退 16.3% (0.8%)
- 血小板数減少 15.1% (6.0%)
- 便秘 13.4% (0.5%)
- 甲状腺機能低下症 13.4% (0.3%)
- 発熱 9.7% (0.5%)
- 口内炎 7.9% (0.3%)
- 体重減少 5.7% (0.3%)
- リンパ球数減少 5.0% (2.3%)
注意すべき有害事象
- 脱毛症 33.1% (0.8%)
- 末梢性ニューロパチー 10.2% (1.0%)
- 末梢性感覚ニューロパチー 9.2% (1.3%)
特徴と注意点
- PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌にたいして使用。
- PD-L1検査でCPS≧10にて有効性が確認されている。
- 免疫チェックポイント阻害薬の有害事象は多岐にわたり、 発現時期も明確でないため、 患者の体調変化を注意深く観察する必要がある。
- ペムブロリズマブ投与時は、 インラインフィルター (0.2~5μm) を使用する。
- nab-PTXは人血清アルブミンを用いており、 特定生物由来製品に該当する。 投与した場合は、 医薬品名 (販売名) 、 製造番号又は製造記号 (ロット番号) 、 使用年月日、使用した患者の氏名、 住所等を記載し少なくとも20年間の保管が必要となる。
- nab-PTXの投与にあたっては、 ヒト血液を原料としていることに由来する感染症伝播のリスクを完全に排除できないことなど、 リスクについても十分に患者に対して説明し、 理解を得る必要がある。
参考文献
最終更新日:2023年10月18日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。