T-DXd
トラスツズマブ デルクステカン (エンハーツ®︎)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します¹⁾
用法用量

通常、 成人には1回5.4mg/kg (体重) を90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。
減量レベル
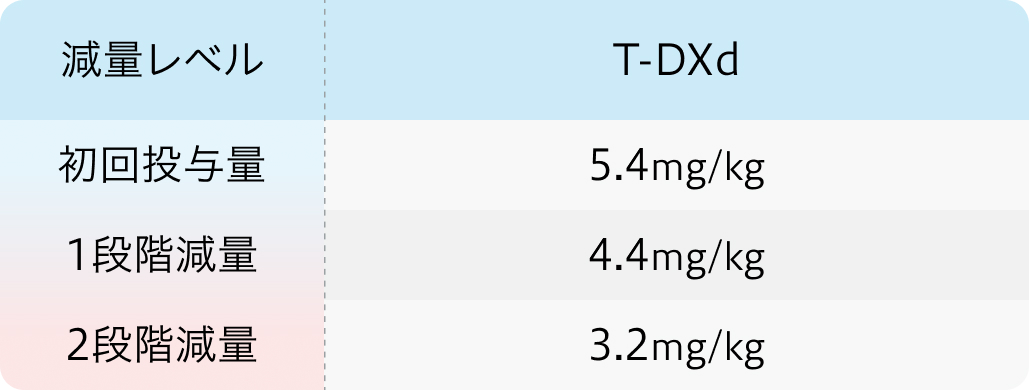
3.2mg/kgで忍容性が得られない場合、 中止
参考:催吐性と前投薬
NCCNガイドライン²⁾では高度催吐性、 2023年10月改訂の国内ガイドライン³⁾では中等度催吐性として扱われている。 制吐薬として、 NK1拮抗薬や5HT3拮抗薬、 ステロイド、 それらの併用を投与することがある。
減量・休薬・中止基準
適正使用ガイド 2023年8月改訂、 電子添付文書をもとに作成 (NCI-CTCAE ver.5.0)
1) 間質性肺疾患
- Grade1:投与中止し、 原則再開しない
ただし、 すべての所見が消失し、 かつ治療上の有益性が危険性を大きく上回ると判断された場合のみ、 1用量レベル減量して投与再開こともでき、 再発した場合は、 投与を中止する
- Grade2~4:投与中止
2) 左室駆出率 (LVEF) 低下
- 40%≦LVEF≦45%・ベースラインからの絶対値の低下<10%:休薬を考慮し、 3週間以内に再測定を行い、 LVEFを確認する。
- 40%≦LVEF≦45%・10%≦ベースラインからの絶対値の低下≦20%:休薬し、 3週間以内に再測定を行い、 LVEFのベースラインからの絶対値の低下<10%に回復しない場合は、 投与中止
- LVEF<40%又はLVEFのベースラインからの絶対値の低下>20%:休薬し、 3週間以内に再測定を行い、 再度LVEF<40%又はベースラインからの絶対値の低下>20%が認められた場合は、 投与中止
3) 症候性うっ血性心不全
- 投与中止
4) QT間隔延長
- Grade3:Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
- Grade4:投与中止
5) Infusion reaction
- Grade1:投与速度を50%減速し、 他の症状が出現しない場合は、 次回以降は元の速度で投与
- Grade2:Grade1以下に回復まで投与中断
再開する場合は投与速度を50%減速し、 次回以降も減速した速度で投与する
- Grade3~4:投与中止
6) 好中球数減少
- Grade3:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量又は同一用量で投与再開
- Grade4:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
7) 発熱性好中球減少症
- 回復するまで休薬し、 回復後、 1用量レベル減量して投与再開
8) 貧血
- Grade3:Grade2以下に回復まで休薬し、 回復後、 同一用量で投与再開
- Grade4:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
9) 血小板数減少
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
10) 総ビリルビン増加
- Grade2:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 1用量レベル減量して投与再開し、 7日を過ぎてから回復した場合、 投与を中止する
- Grade4:投与中止
11) 下痢又は大腸炎
- Grade3:Grade1以下に回復まで休薬
3日以内に回復した場合、 同一用量で投与再開し、 3日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:投与中止
12) 前記以外の副作用
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:投与中止
主な有害事象
DESTINY-Breast01試験⁴⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 悪心 77.7% (7.6%)
- 倦怠感 49.5% (6.0%)
- 嘔吐 45.7% (4.3%)
- 便秘 35.9% (0.5%)
- 好中球数減少 34.8% (20.7%)
- 食欲低下 31.0% (16.0%)
- 貧血 29.9% (8.7%)
- 下痢 29.3% (2.7%)
- 白血球数減少 21.2% (6.5%)
- 血小板数減少 21.2% (4.3%)
注意すべき有害事象
- 脱毛症 48.4% (0.5%)
DESTINY-Breast04試験⁵⁾
有害事象データを一部引用 (カッコ内はGrade3~5)
主な有害事象
- 好中球減少症 33.2% (13.7%)
- 貧血 33.2% (8.1%)
- 血小板減少症 23.7% (5.1%)
- 白血球減少症 23.2% (6.5%)
- 悪心 73.0% (4.6%)
- 嘔吐 34.0% (1.3%)
- 下痢 22.4% (1.1%)
- 便秘 21.3% (0%)
- ALT増加 23.5% (3.2%)
- 倦怠感 47.7% (7.5%)
- 食欲低下 28.6% (2.4%)
- 間質性肺炎 12.1% (2.1%)
Grade3は1.3%、 Grade5は0.8%
注意すべき有害事象
- 脱毛症 37.7% (0%)
特徴と注意点
乳癌の適応
電子化された添付文書の記載は 「化学療法歴のあるHER2陽性の手術不能又は再発乳癌、 および化学療法歴のあるHER2低発現の手術不能又は再発乳癌」である。
T-DXdについて
ヒトHER2を標的とした抗体薬物複合体 (ADC)。 抗HER2ヒト化モノクローナル抗体とトポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体 (DXd) を、 腫瘍細胞内切断型ペプチド含有リンカーを介して結合した薬剤。
副作用マネジメント
アンスラサイクリン系の投与歴、 胸部への放射線照射の治療歴、 心疾患合併又は既往歴のある患者では心機能低下が起こるおそれがあるため、 投与に際しては特に注意が必要。 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
間質性肺疾患のある患者又はその既往歴のある患者では間質性肺疾患が発現又は増悪し、 死亡に至る可能性があるため投与に際し、 特に注意が必要。 投与開始前に必ず胸部CT検査、 胸部X線検査、動脈血酸素飽和度 (SpO₂) 検査及び問診を実施する。
その他の注意点
一般名が類似しているトラスツズマブ及びトラスツズマブ エムタンシンとの取り違えが起こらないように処方、 調剤時には十分注意する。 また、 カンプトテシン誘導体を含むが、 グルクロン酸抱合体の検出はなく、 また、ヒト肝ミクロソームを用いた検討からもUGT依存的な代謝は認められていないため、 UGT1A1の遺伝子多型が有効性・安全性に影響する可能性は低いと考えられている。
関連する臨床試験|DESTINY-Breast01試験⁴⁾
トラスツズマブ エムタンシン (T-DM1) 投与歴のある、 HER2陽性の切除不能または転移性乳癌患者において、 抗HER2抗体薬物複合体トラスツズマブ デルクステカン(T-DXd) 投与の効果を検証した単群コホートの第Ⅱ相試験DESTINY-Breast01の結果より、 高い奏効率 (ORR) が示された。
ORR
61.4%
奏効期間 (中央値)
20.8ヵ月
(95%CI 15.0ヵ月-NE)
PFS
19.4ヵ月
(95%CI 14.1ヵ月-NE)
OS率 (6ヵ月時、 12ヵ月時、 18ヵ月時)
93.9%、 85%、 74%
病勢コントロール率
97.3%
(95%CI 93.8-99.1%)
参考文献
- 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2023年8月改訂 [最終閲覧日 2023/11/12]
- NCCN guidelines. Antiemesis Version 2.2023
- 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
- Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621. PMID: 31825192
- Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. PMID: 35665782
最終更新日:2023年11月8日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
T-DXd
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します¹⁾
用法用量

通常、 成人には1回5.4mg/kg (体重) を90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。
減量レベル

3.2mg/kgで忍容性が得られない場合、 中止
参考:催吐性と前投薬
NCCNガイドライン²⁾では高度催吐性、 2023年10月改訂の国内ガイドライン³⁾では中等度催吐性として扱われている。 制吐薬として、 NK1拮抗薬や5HT3拮抗薬、 ステロイド、 それらの併用を投与することがある。
減量・休薬・中止基準
適正使用ガイド 2023年8月改訂、 電子添付文書をもとに作成 (NCI-CTCAE ver.5.0)
1) 間質性肺疾患
- Grade1:投与中止し、 原則再開しない
ただし、 すべての所見が消失し、 かつ治療上の有益性が危険性を大きく上回ると判断された場合のみ、 1用量レベル減量して投与再開こともでき、 再発した場合は、 投与を中止する
- Grade2~4:投与中止
2) 左室駆出率 (LVEF) 低下
- 40%≦LVEF≦45%・ベースラインからの絶対値の低下<10%:休薬を考慮し、 3週間以内に再測定を行い、 LVEFを確認する。
- 40%≦LVEF≦45%・10%≦ベースラインからの絶対値の低下≦20%:休薬し、 3週間以内に再測定を行い、 LVEFのベースラインからの絶対値の低下<10%に回復しない場合は、 投与中止
- LVEF<40%又はLVEFのベースラインからの絶対値の低下>20%:休薬し、 3週間以内に再測定を行い、 再度LVEF<40%又はベースラインからの絶対値の低下>20%が認められた場合は、 投与中止
3) 症候性うっ血性心不全
- 投与中止
4) QT間隔延長
- Grade3:Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
- Grade4:投与中止
5) Infusion reaction
- Grade1:投与速度を50%減速し、 他の症状が出現しない場合は、 次回以降は元の速度で投与
- Grade2:Grade1以下に回復まで投与中断
再開する場合は投与速度を50%減速し、 次回以降も減速した速度で投与する
- Grade3~4:投与中止
6) 好中球数減少
- Grade3:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量又は同一用量で投与再開
- Grade4:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
7) 発熱性好中球減少症
- 回復するまで休薬し、 回復後、 1用量レベル減量して投与再開
8) 貧血
- Grade3:Grade2以下に回復まで休薬し、 回復後、 同一用量で投与再開
- Grade4:Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
9) 血小板数減少
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
10) 総ビリルビン増加
- Grade2:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 1用量レベル減量して投与再開し、 7日を過ぎてから回復した場合、 投与を中止する
- Grade4:投与中止
11) 下痢又は大腸炎
- Grade3:Grade1以下に回復まで休薬
3日以内に回復した場合、 同一用量で投与再開し、 3日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:投与中止
12) 前記以外の副作用
- Grade3:Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4:投与中止
主な有害事象
DESTINY-Breast01試験⁴⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 悪心 77.7% (7.6%)
- 倦怠感 49.5% (6.0%)
- 嘔吐 45.7% (4.3%)
- 便秘 35.9% (0.5%)
- 好中球数減少 34.8% (20.7%)
- 食欲低下 31.0% (16.0%)
- 貧血 29.9% (8.7%)
- 下痢 29.3% (2.7%)
- 白血球数減少 21.2% (6.5%)
- 血小板数減少 21.2% (4.3%)
注意すべき有害事象
- 脱毛症 48.4% (0.5%)
DESTINY-Breast04試験⁵⁾
有害事象データを一部引用 (カッコ内はGrade3~5)
主な有害事象
- 好中球減少症 33.2% (13.7%)
- 貧血 33.2% (8.1%)
- 血小板減少症 23.7% (5.1%)
- 白血球減少症 23.2% (6.5%)
- 悪心 73.0% (4.6%)
- 嘔吐 34.0% (1.3%)
- 下痢 22.4% (1.1%)
- 便秘 21.3% (0%)
- ALT増加 23.5% (3.2%)
- 倦怠感 47.7% (7.5%)
- 食欲低下 28.6% (2.4%)
- 間質性肺炎 12.1% (2.1%)
Grade3は1.3%、 Grade5は0.8%
注意すべき有害事象
- 脱毛症 37.7% (0%)
特徴と注意点
乳癌の適応
電子化された添付文書の記載は 「化学療法歴のあるHER2陽性の手術不能又は再発乳癌、 および化学療法歴のあるHER2低発現の手術不能又は再発乳癌」である。
T-DXdについて
ヒトHER2を標的とした抗体薬物複合体 (ADC)。 抗HER2ヒト化モノクローナル抗体とトポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体 (DXd) を、 腫瘍細胞内切断型ペプチド含有リンカーを介して結合した薬剤。
副作用マネジメント
アンスラサイクリン系の投与歴、 胸部への放射線照射の治療歴、 心疾患合併又は既往歴のある患者では心機能低下が起こるおそれがあるため、 投与に際しては特に注意が必要。 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
間質性肺疾患のある患者又はその既往歴のある患者では間質性肺疾患が発現又は増悪し、 死亡に至る可能性があるため投与に際し、 特に注意が必要。 投与開始前に必ず胸部CT検査、 胸部X線検査、動脈血酸素飽和度 (SpO₂) 検査及び問診を実施する。
その他の注意点
一般名が類似しているトラスツズマブ及びトラスツズマブ エムタンシンとの取り違えが起こらないように処方、 調剤時には十分注意する。 また、 カンプトテシン誘導体を含むが、 グルクロン酸抱合体の検出はなく、 また、ヒト肝ミクロソームを用いた検討からもUGT依存的な代謝は認められていないため、 UGT1A1の遺伝子多型が有効性・安全性に影響する可能性は低いと考えられている。
関連する臨床試験|DESTINY-Breast01試験⁴⁾
トラスツズマブ エムタンシン (T-DM1) 投与歴のある、 HER2陽性の切除不能または転移性乳癌患者において、 抗HER2抗体薬物複合体トラスツズマブ デルクステカン(T-DXd) 投与の効果を検証した単群コホートの第Ⅱ相試験DESTINY-Breast01の結果より、 高い奏効率 (ORR) が示された。
ORR
61.4%
奏効期間 (中央値)
20.8ヵ月
(95%CI 15.0ヵ月-NE)
PFS
19.4ヵ月
(95%CI 14.1ヵ月-NE)
OS率 (6ヵ月時、 12ヵ月時、 18ヵ月時)
93.9%、 85%、 74%
病勢コントロール率
97.3%
(95%CI 93.8-99.1%)
参考文献
- 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2023年8月改訂 [最終閲覧日 2023/11/12]
- NCCN guidelines. Antiemesis Version 2.2023
- 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
- Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621. PMID: 31825192
- Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. PMID: 35665782
最終更新日:2023年11月8日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。